2025年新坐标同步练习高中化学选择性必修第一册人教版青海专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新坐标同步练习高中化学选择性必修第一册人教版青海专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第98页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
1. (2025·湖北高二联考)室温时,向 $20 \, mL \, 0.1 \, mol \cdot L^{-1}$ 的醋酸中不断滴入 $0.1 \, mol \cdot L^{-1}$ 的 $NaOH$ 溶液,溶液的 $ pH $ 变化曲线如下图所示。在滴定过程中,下列关于溶液中粒子浓度大小关系的描述不正确的是(

A.$a$ 点时:$c(CH_3COOH) > c(Na^+) > c(CH_3COO^-) > c(H^+) > c(OH^-)$
B.$b$ 点时:$c(Na^+) = c(CH_3COO^-) > c(H^+) = c(OH^-)$
C.$c$ 点时:$c(OH^-) = c(CH_3COOH) + c(H^+)$
D.$d$ 点时:$2c(Na^+) = 3c(CH_3COO^-) + 3c(CH_3COOH)$
A
)
A.$a$ 点时:$c(CH_3COOH) > c(Na^+) > c(CH_3COO^-) > c(H^+) > c(OH^-)$
B.$b$ 点时:$c(Na^+) = c(CH_3COO^-) > c(H^+) = c(OH^-)$
C.$c$ 点时:$c(OH^-) = c(CH_3COOH) + c(H^+)$
D.$d$ 点时:$2c(Na^+) = 3c(CH_3COO^-) + 3c(CH_3COOH)$
答案:
解析:选A。反应前n(CH₃COOH)=0.002 mol,a点时n(NaOH)=0.001 mol,此时溶液中溶质为等物质的量的CH₃COOH和CH₃COONa,因为溶液的pH<7,所以CH₃COOH的电离程度大于CH₃COO⁻的水解程度,故c(CH₃COO⁻)>c(Na⁺)>c(CH₃COOH)>c(H⁺)>c(OH⁻),A不正确;b点时,pH=7,溶液呈中性,c(H⁺)=c(OH⁻),依据电荷守恒,可得出c(Na⁺)=c(CH₃COO⁻),由于水的电离程度很小,所以c(Na⁺)=c(CH₃COO⁻)>c(H⁺)=c(OH⁻),B正确;c点时,CH₃COOH与NaOH刚好完全反应生成CH₃COONa和H₂O,CH₃COONa溶液中存在质子守恒:c(OH⁻)=c(CH₃COOH)+c(H⁺),C正确;d点时溶液中溶质为CH₃COONa和NaOH,且二者物质的量之比为2:1,依据元素守恒可得2c(Na⁺)=3c(CH₃COO⁻)+3c(CH₃COOH),D正确。
2. $H_2C_2O_4$ 是二元弱酸。向 $100 \, mL \, 0.40 \, mol/L$ $H_2C_2O_4$ 溶液中加入 $1.0 \, mol/L \, NaOH$ 溶液调节 $ pH $,加水控制溶液体积为 $200 \, mL$。测得溶液中微粒的 $\delta(x)$ 随 $ pH $ 变化曲线如下图所示 $[\delta(x) = \frac{c(x)}{c(H_2C_2O_4) + c(HC_2O_4^-) + c(C_2O_4^{2-})}, x$ 代表微粒 $H_2C_2O_4$、$HC_2O_4^-$ 或 $C_2O_4^{2-}$ ]。下列叙述正确的是(
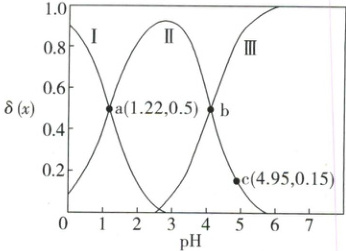
A.曲线Ⅰ 是 $HC_2O_4^-$ 的变化曲线
B.$H_2C_2O_4$ 的电离常数 $K_{a1} = 1.0 × 10^{-1.22}$
C.在 $b$ 点,$c(C_2O_4^{2-}) + 2c(OH^-) = c(HC_2O_4^-) + c(H^+)$
D.在 $c$ 点,$c(HC_2O_4^-) = 0.06 \, mol/L$
B
)
A.曲线Ⅰ 是 $HC_2O_4^-$ 的变化曲线
B.$H_2C_2O_4$ 的电离常数 $K_{a1} = 1.0 × 10^{-1.22}$
C.在 $b$ 点,$c(C_2O_4^{2-}) + 2c(OH^-) = c(HC_2O_4^-) + c(H^+)$
D.在 $c$ 点,$c(HC_2O_4^-) = 0.06 \, mol/L$
答案:
解析:选B。溶液酸性越强,曲线Ⅰ表示的微粒的含量越高,可推知曲线Ⅰ是H₂C₂O₄的变化曲线,曲线Ⅱ是HC₂O₄⁻的变化曲线,曲线Ⅲ是C₂O₄²⁻的变化曲线,A错误;在a点,c(H₂C₂O₄)=c(HC₂O₄⁻),pH=1.22,H₂C₂O₄的电离常数$K_{a1}=\frac{c(HC_{2}O_{4}^{-})\cdot c(H^{+})}{c(H_{2}C_{2}O_{4})}=c(H^{+})=1.0×10^{-1.22}$,B正确;在b点,c(C₂O₄²⁻)=c(HC₂O₄⁻),且溶液呈酸性,若c(C₂O₄²⁻)+2c(OH⁻)=c(HC₂O₄⁻)+c(H⁺),则2c(OH⁻)=c(H⁺),显然不成立,C错误;在c点,HC₂O₄⁻的分布系数为0.15,而H₂C₂O₄、HC₂O₄⁻、C₂O₄²⁻的总物质的量为0.1 L×0.40 mol/L=0.04 mol,故HC₂O₄⁻的物质的量为0.15×0.04 mol=0.006 mol,溶液体积为0.2 L,故$c(HC_{2}O_{4}^{-})=\frac{0.006\ mol}{0.2\ L}=0.03\ mol/L$,D错误。
3. (2023·湖南卷)常温下,用浓度为 $0.0200 \, mol \cdot L^{-1}$ 的 $NaOH$ 标准溶液滴定浓度均为 $0.0200 \, mol \cdot L^{-1}$ 的 $HCl$ 和 $CH_3COOH$ 的混合溶液,滴定过程中溶液的 $ pH $ 随 $ \eta [\eta = \frac{V(标准溶液)}{V(待测溶液)}]$ 的变化曲线如下图所示。下列说法错误的是(
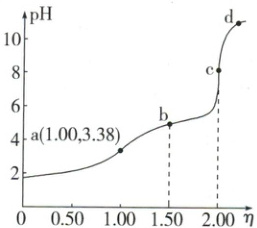
A.$K_a(CH_3COOH)$ 约为 $10^{-4.76}$
B.点 $a$:$c(Na^+) = c(Cl^-) = c(CH_3COO^-) + c(CH_3COOH)$
C.点 $b$:$c(CH_3COOH) < c(CH_3COO^-)$
D.水的电离程度:$a < b < c < d$
D
)
A.$K_a(CH_3COOH)$ 约为 $10^{-4.76}$
B.点 $a$:$c(Na^+) = c(Cl^-) = c(CH_3COO^-) + c(CH_3COOH)$
C.点 $b$:$c(CH_3COOH) < c(CH_3COO^-)$
D.水的电离程度:$a < b < c < d$
答案:
解析:选D。a点HCl恰好被完全中和,溶质为等物质的量的NaCl和CH₃COOH,根据CH₃COOH⇌CH₃COO⁻+H⁺,可近似认为a点c(H⁺)=c(CH₃COO⁻),又a点pH=3.38,c(H⁺)=10⁻³.³⁸ mol·L⁻¹,故$K_{a}(CH_{3}COOH)\approx\frac{10^{-3.38}×10^{-3.38}}{0.0100}=10^{-4.76}$,A项正确;由元素守恒可得a点溶液中c(Na⁺)=c(Cl⁻)=c(CH₃COO⁻)+c(CH₃COOH),B项正确;b点CH₃COOH被中和了一半,溶质为NaCl及等物质的量浓度的CH₃COOH和CH₃COONa,溶液pH<7,说明CH₃COOH的电离大于CH₃COO⁻的水解,故c(CH₃COOH)<c(CH₃COO⁻),C项正确;a、b两点溶液呈酸性,水的电离均受到抑制,溶液pH越小,水的电离受抑制程度越大,c点酸碱恰好完全中和,CH₃COO⁻水解促进水的电离,d点NaOH过量,又抑制水的电离,D项错误。
4. (2023·福建卷)$25^{\circ} C$ 时,某二元酸 $(H_2A)$ 的 $K_{a1} = 10^{-3.04}$、$K_{a2} = 10^{-4.37}$。$1.0 \, mol \cdot L^{-1} \, NaHA$ 溶液稀释过程中 $\delta(H_2A)$、$\delta(HA^-)$、$\delta(A^{2-})$ 与 $pc(Na^+)$ 的关系如下图所示。已知 $pc(Na^+) = -\lg c(Na^+)$,$HA^-$ 的分布系数 $\delta(HA^-) = \frac{c(HA^-)}{c(H_2A) + c(HA^-) + c(A^{2-})}$。下列说法错误的是(
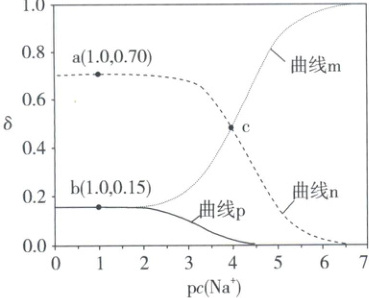
A.曲线 $n$ 为 $\delta(HA^-)$ 的变化曲线
B.$a$ 点:$ pH = 4.37$
C.$b$ 点:$2c(H_2A) + c(HA^-) = c(Na^+)$
D.$c$ 点:$c(Na^+) + c(H^+) = 3c(HA^-) + c(OH^-)$
B
)
A.曲线 $n$ 为 $\delta(HA^-)$ 的变化曲线
B.$a$ 点:$ pH = 4.37$
C.$b$ 点:$2c(H_2A) + c(HA^-) = c(Na^+)$
D.$c$ 点:$c(Na^+) + c(H^+) = 3c(HA^-) + c(OH^-)$
答案:
解析:选B。1.0 mol·L⁻¹ NaHA溶液稀释过程中,存在电离平衡:HA⁻⇌H⁺+A²⁻和水解平衡:HA⁻+H₂O⇌OH⁻+H₂A,HA⁻的水解常数$K_{h}=\frac{10^{-14}}{10^{-3.04}}=10^{-10.96}\lt K_{a2}$,故HA⁻的电离程度大于水解程度,稀释过程中c(A²⁻)>c(H₂A),因此曲线n为δ(HA⁻)的变化曲线,曲线m为δ(A²⁻)的变化曲线,曲线p为δ(H₂A)的变化曲线,选项A正确;a点时,pc(Na⁺)=1,c(Na⁺)=0.1 mol·L⁻¹,δ(HA⁻)=0.70,b点时,δ(H₂A)=δ(A²⁻)=0.15,$K_{a2}=\frac{c(A^{2-})\cdot c(H^{+})}{c(HA^{-})}=10^{-4.37}$,$c(H^{+})=\frac{0.15}{0.70}×10^{-4.37}$,pH≠4.37,选项B错误;b点:δ(H₂A)=δ(A²⁻),故c(H₂A)=c(A²⁻),根据元素守恒c(A²⁻)+c(H₂A)+c(HA⁻)=c(Na⁺),故2c(H₂A)+c(HA⁻)=c(Na⁺),选项C正确;c点:δ(HA⁻)=δ(A²⁻),故c(HA⁻)=c(A²⁻),根据电荷守恒有c(Na⁺)+c(H⁺)=2c(A²⁻)+c(HA⁻)+c(OH⁻),故c(Na⁺)+c(H⁺)=3c(HA⁻)+c(OH⁻),选项D正确。
查看更多完整答案,请扫码查看


