2025年新坐标同步练习高中化学选择性必修第一册人教版青海专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新坐标同步练习高中化学选择性必修第一册人教版青海专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第6页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
自我诊断
(1) 化学反应的反应热仅指反应放出的热量 (
(2) 热化学方程式未注明温度和压强时,$\Delta H$表示标准状况下的数据 (
(3) 化学反应中所吸收或放出的热量与反应物的物质的量成正比 (
(4) 同一化学反应,化学计量数相同而聚集状态不同,$\Delta H$也不同 (
(1) 化学反应的反应热仅指反应放出的热量 (
×
)(2) 热化学方程式未注明温度和压强时,$\Delta H$表示标准状况下的数据 (
×
)(3) 化学反应中所吸收或放出的热量与反应物的物质的量成正比 (
√
)(4) 同一化学反应,化学计量数相同而聚集状态不同,$\Delta H$也不同 (
√
)
答案:
(1)×
(2)×
(3)√
(4)√
(1)×
(2)×
(3)√
(4)√
1. (2025·成都高二月考)下列有关热化学方程式的说法不正确的是 (
A.能同时表明反应中的物质变化和能量变化
B.书写条件为“$25^{\circ}C$、$101kPa$”时,可以不特别注明
C.化学计量数只表示分子个数
D.$\Delta H$表示“每摩尔反应”对应的“热量”
C
)A.能同时表明反应中的物质变化和能量变化
B.书写条件为“$25^{\circ}C$、$101kPa$”时,可以不特别注明
C.化学计量数只表示分子个数
D.$\Delta H$表示“每摩尔反应”对应的“热量”
答案:
C
2. 已知在$1×10^{5}Pa$、$298K$条件下,$1mol氢气完全燃烧生成水蒸气放出242kJ$热量。下列热化学方程式正确的是 (
A.$H_{2}(g)+\frac{1}{2}O_{2}(g)= H_{2}O(g)$ $\Delta H= +242kJ\cdot mol^{-1}$
B.$H_{2}O(g)= H_{2}(g)+\frac{1}{2}O_{2}(g)$ $\Delta H= +242kJ\cdot mol^{-1}$
C.$2H_{2}(g)+O_{2}(g)= 2H_{2}O(l)$ $\Delta H= -484kJ\cdot mol^{-1}$
D.$2H_{2}(g)+O_{2}(g)= 2H_{2}O(g)$ $\Delta H= +484kJ\cdot mol^{-1}$
B
)A.$H_{2}(g)+\frac{1}{2}O_{2}(g)= H_{2}O(g)$ $\Delta H= +242kJ\cdot mol^{-1}$
B.$H_{2}O(g)= H_{2}(g)+\frac{1}{2}O_{2}(g)$ $\Delta H= +242kJ\cdot mol^{-1}$
C.$2H_{2}(g)+O_{2}(g)= 2H_{2}O(l)$ $\Delta H= -484kJ\cdot mol^{-1}$
D.$2H_{2}(g)+O_{2}(g)= 2H_{2}O(g)$ $\Delta H= +484kJ\cdot mol^{-1}$
答案:
B
3. 写出下列反应的热化学方程式。
(1) $32gCu(s)与适量O_{2}(g)反应生成CuO(s)放出78.5kJ$的热量:
(2) $1.7gNH_{3}(g)发生催化氧化反应生成气态产物放出22.67kJ$的热量:
(3) $25^{\circ}C$、$101kPa$下,强酸、强碱的稀溶液发生中和反应生成$1molH_{2}O(l)$时,放出$57.3kJ$的热量:
(4) 已知:$N_{2}(g)+3H_{2}(g)\rightleftharpoons 2NH_{3}(g)$ $\Delta H= -92kJ\cdot mol^{-1}$。请写出$1molNH_{3}$分解对应的热化学方程式:
(1) $32gCu(s)与适量O_{2}(g)反应生成CuO(s)放出78.5kJ$的热量:
Cu(s)+$\frac{1}{2}$O₂(g)$\xlongequal{}$CuO(s) ΔH=-157 kJ·mol⁻¹
。(2) $1.7gNH_{3}(g)发生催化氧化反应生成气态产物放出22.67kJ$的热量:
NH₃(g)+$\frac{5}{4}$O₂(g)$\xlongequal{}$NO(g)+$\frac{3}{2}$H₂O(g) ΔH=-226.7 kJ·mol⁻¹
。(3) $25^{\circ}C$、$101kPa$下,强酸、强碱的稀溶液发生中和反应生成$1molH_{2}O(l)$时,放出$57.3kJ$的热量:
H⁺(aq)+OH⁻(aq)$\xlongequal{}$H₂O(l) ΔH=-57.3 kJ·mol⁻¹
。(4) 已知:$N_{2}(g)+3H_{2}(g)\rightleftharpoons 2NH_{3}(g)$ $\Delta H= -92kJ\cdot mol^{-1}$。请写出$1molNH_{3}$分解对应的热化学方程式:
NH₃(g)$\xlongequal{}$$\frac{1}{2}$N₂(g)+$\frac{3}{2}$H₂(g) ΔH=+46 kJ·mol⁻¹
。
答案:
1.
(1)Cu(s)+$\frac{1}{2}$O₂(g)$\xlongequal{}$CuO(s) ΔH=-157 kJ·mol⁻¹
(2)NH₃(g)+$\frac{5}{4}$O₂(g)$\xlongequal{}$NO(g)+$\frac{3}{2}$H₂O(g) ΔH=-226.7 kJ·mol⁻¹
(3)H⁺(aq)+OH⁻(aq)$\xlongequal{}$H₂O(l) ΔH=-57.3 kJ·mol⁻¹
(4)NH₃(g)$\xlongequal{}$$\frac{1}{2}$N₂(g)+$\frac{3}{2}$H₂(g) ΔH=+46 kJ·mol⁻¹
(1)Cu(s)+$\frac{1}{2}$O₂(g)$\xlongequal{}$CuO(s) ΔH=-157 kJ·mol⁻¹
(2)NH₃(g)+$\frac{5}{4}$O₂(g)$\xlongequal{}$NO(g)+$\frac{3}{2}$H₂O(g) ΔH=-226.7 kJ·mol⁻¹
(3)H⁺(aq)+OH⁻(aq)$\xlongequal{}$H₂O(l) ΔH=-57.3 kJ·mol⁻¹
(4)NH₃(g)$\xlongequal{}$$\frac{1}{2}$N₂(g)+$\frac{3}{2}$H₂(g) ΔH=+46 kJ·mol⁻¹
1. 概念:在$101kPa$时,①
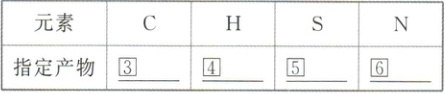
1 mol
纯物质完全燃烧生成指定产物时所放出的热量。单位是②kJ/mol 或 kJ·mol⁻¹
。
答案:
①1 mol ②kJ/mol 或 kJ·mol⁻¹ ③CO₂(g) ④H₂O(l) ⑤SO₂(g) ⑥N₂(g)
已知:$CO(g)的燃烧热\Delta H为-283kJ\cdot mol^{-1}$,写出表示$CO(g)$燃烧热的热化学方程式:
CO(g)+$\frac{1}{2}$O₂(g)$\xlongequal{}$CO₂(g) ΔH=-283 kJ·mol⁻¹
。
答案:
CO(g)+$\frac{1}{2}$O₂(g)$\xlongequal{}$CO₂(g) ΔH=-283 kJ·mol⁻¹
2. 意义:$25^{\circ}C和101kPa$时,甲烷的燃烧热$\Delta H为-890.3kJ/mol$,热化学方程式为$CH_{4}(g)+2O_{2}(g)= CO_{2}(g)+2H_{2}O(l)$ $\Delta H= -890.3kJ/mol$表示⑦
25 ℃和 101 kPa 时,1 mol CH₄(g)完全燃烧生成 CO₂(g)和 H₂O(l)时放出 890.3 kJ 的热量
。
答案:
⑦25 ℃和 101 kPa 时,1 mol CH₄(g)完全燃烧生成 CO₂(g)和 H₂O(l)时放出 890.3 kJ 的热量
自我诊断
(1) 燃烧热所指的燃烧产物一定是相应元素的最高价氧化物 (
(2) 含碳物质燃烧生成$1molCO_{2}$时所放出的热量是燃烧热 (
(3) 实验测定$H_{2}的燃烧热时与所用H_{2}$量的多少无关 (
(4) $1molC燃烧生成CO_{2}时放出的热量是生成CO时放出的热量的2$倍 (
(1) 燃烧热所指的燃烧产物一定是相应元素的最高价氧化物 (
×
)(2) 含碳物质燃烧生成$1molCO_{2}$时所放出的热量是燃烧热 (
×
)(3) 实验测定$H_{2}的燃烧热时与所用H_{2}$量的多少无关 (
√
)(4) $1molC燃烧生成CO_{2}时放出的热量是生成CO时放出的热量的2$倍 (
×
)
答案:
(1)×
(2)×
(3)√
(4)×
(1)×
(2)×
(3)√
(4)×
查看更多完整答案,请扫码查看


