2025年新坐标同步练习高中化学选择性必修第一册人教版青海专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新坐标同步练习高中化学选择性必修第一册人教版青海专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第3页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
1. 内能:体系内物质的各种能量的总和,受①
温度
、②压强
和③物质的聚集状态
等影响。
答案:
①温度 ②压强 ③物质的聚集状态
2. 焓与焓变


答案:
④H ⑤生成物 ⑥反应物 ⑦H(生成物) ⑧H(反应物) ⑨kJ·mol⁻¹ ⑩kJ/mol
3. 反应热产生的原因
(1)从宏观反应体系始末状态的能量视角分析
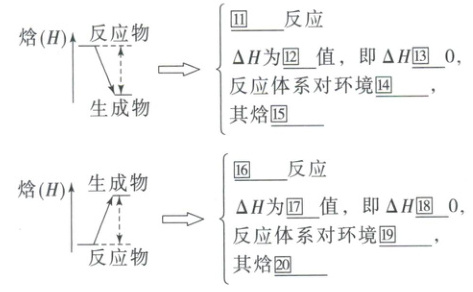
$\Delta H=$㉑
学思用1. (1)有下列常见的化学反应:
①大多数的分解反应
②大多数的化合反应
③铝热反应
④C和$H_{2}O(g)$的反应
⑤中和反应
⑥可燃物的燃烧
⑦金属与酸的置换反应
其中属于放热反应的是
(2)“放热反应不需要加热就能发生,吸热反应不加热就不能发生”。这种说法对吗?请简述原因:
(2)从微观反应过程中化学键的变化视角分析
以反应$H_{2}(g)+Cl_{2}(g)= 2HCl(g)$的能量变化为例说明,如下图所示:
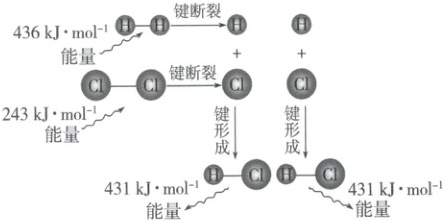
$\Delta H=$㉓
化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因,$\Delta H = E$(㉔
学思用2. 在光照或点燃条件下,$H_{2}(g)和Cl_{2}(g)$均可以发生上述反应,$\Delta H$
(1)从宏观反应体系始末状态的能量视角分析

$\Delta H=$㉑
生成物
总能量$-$㉒反应物
总能量。学思用1. (1)有下列常见的化学反应:
①大多数的分解反应
②大多数的化合反应
③铝热反应
④C和$H_{2}O(g)$的反应
⑤中和反应
⑥可燃物的燃烧
⑦金属与酸的置换反应
其中属于放热反应的是
②③⑤⑥⑦
(填序号,下同),属于吸热反应的是①④
。(2)“放热反应不需要加热就能发生,吸热反应不加热就不能发生”。这种说法对吗?请简述原因:
不对,有的放热反应需要加热甚至高温才能发生,如木炭燃烧、铝热反应等;有的吸热反应不加热也能发生,如Ba(OH)₂·8H₂O晶体和NH₄Cl晶体、NaHCO₃和盐酸的反应等
。(2)从微观反应过程中化学键的变化视角分析
以反应$H_{2}(g)+Cl_{2}(g)= 2HCl(g)$的能量变化为例说明,如下图所示:

$\Delta H=$㉓
(436+243)kJ·mol⁻¹-(431+431)kJ·mol⁻¹=-183 kJ·mol⁻¹
。化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因,$\Delta H = E$(㉔
反应物
的总键能)$- E$(㉕生成物
的总键能)。学思用2. 在光照或点燃条件下,$H_{2}(g)和Cl_{2}(g)$均可以发生上述反应,$\Delta H$
相同
(填“相同”或“不同”),原因是化学反应的焓变与反应条件无关
。
答案:
⑪放热 ⑫负 ⑬< ⑭放热 ⑮减小 ⑯吸热 ⑰正 ⑱> ⑲吸热 ⑳增加 ㉑生成物 ㉒反应物 ㉓(436+243)kJ·mol⁻¹-(431+431)kJ·mol⁻¹=-183 kJ·mol⁻¹ ㉔反应物 ㉕生成物
(1)②③⑤⑥⑦ ①④
(2)不对,有的放热反应需要加热甚至高温才能发生,如木炭燃烧、铝热反应等;有的吸热反应不加热也能发生,如Ba(OH)₂·8H₂O晶体和NH₄Cl晶体、NaHCO₃和盐酸的反应等 相同 化学反应的焓变与反应条件无关
(1)②③⑤⑥⑦ ①④
(2)不对,有的放热反应需要加热甚至高温才能发生,如木炭燃烧、铝热反应等;有的吸热反应不加热也能发生,如Ba(OH)₂·8H₂O晶体和NH₄Cl晶体、NaHCO₃和盐酸的反应等 相同 化学反应的焓变与反应条件无关
自我诊断
(1)化学反应产生反应热的原因是反应前后体系的内能发生变化(
(2)浓硫酸溶于水时,体系的温度升高,属于放热反应(
(3)伴有能量变化的过程不一定是化学反应,但化学反应都伴有能量变化(
(4)石墨转化为金刚石需要吸收能量,说明石墨更稳定(
(1)化学反应产生反应热的原因是反应前后体系的内能发生变化(
√
)(2)浓硫酸溶于水时,体系的温度升高,属于放热反应(
×
)(3)伴有能量变化的过程不一定是化学反应,但化学反应都伴有能量变化(
√
)(4)石墨转化为金刚石需要吸收能量,说明石墨更稳定(
√
)
答案:
(1)√
(2)×
(3)√
(4)√
(1)√
(2)×
(3)√
(4)√
查看更多完整答案,请扫码查看


