2025年新坐标同步练习高中化学选择性必修第一册人教版青海专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新坐标同步练习高中化学选择性必修第一册人教版青海专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第109页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
1. (2025·云南高二联考) 铬酸钡常用于制颜料、玻璃和陶瓷等。已知:常温下,$K_{sp}(BaCrO_4) = 1.0 × 10^{-10}$,相关溶度积曲线如下图所示。下列推断正确的是(
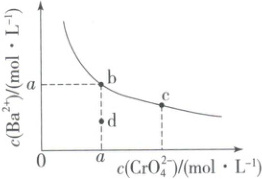
A.升温可使 $c$ 点迁移到 $b$ 点
B.$b$ 点溶度积大于 $c$ 点
C.$a = 1.0 × 10^{-5}$
D.蒸发 $d$ 点溶液可迁移到 $b$ 点
C
)
A.升温可使 $c$ 点迁移到 $b$ 点
B.$b$ 点溶度积大于 $c$ 点
C.$a = 1.0 × 10^{-5}$
D.蒸发 $d$ 点溶液可迁移到 $b$ 点
答案:
解析:选C。曲线上各点处于铬酸钡沉淀溶解平衡状态,升温,溶度积增大,曲线上的点离开曲线,A项错误;曲线上各点对应的溶度积相等,B项错误;b点时,$c({Ba^{2+}})=c({CrO^{2-}_{4}})=\sqrt{K_{sp}({BaCrO_{4}})}=1.0× 10^{-5}\ mol\cdotL^{-1}$,C项正确;蒸发掉水,$c({Ba^{2+}})$、$c({CrO^{2-}_{4}})$都会增大,溶液向c点方向移动,D项错误。
2. (2025·北京朝阳区高二期末) 某温度下,$PbCO_3$ 饱和溶液和 $PbI_2$ 饱和溶液中的阴、阳离子浓度满足如下图所示的关系。下列说法正确的是(
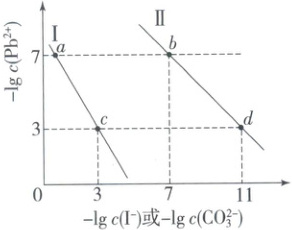
A.曲线Ⅰ表示 $PbCO_3$ 的沉淀溶解平衡
B.该温度下 $K_{sp}(PbI_2) : K_{sp}(PbCO_3) = 10^8$
C.曲线Ⅱ上的 $b$ 点可通过改变温度移动至 $d$ 点
D.向 $PbI_2$ 的悬浊液中加入 $Na_2CO_3$ 浓溶液,可以将其转化成 $PbCO_3$
D
)
A.曲线Ⅰ表示 $PbCO_3$ 的沉淀溶解平衡
B.该温度下 $K_{sp}(PbI_2) : K_{sp}(PbCO_3) = 10^8$
C.曲线Ⅱ上的 $b$ 点可通过改变温度移动至 $d$ 点
D.向 $PbI_2$ 的悬浊液中加入 $Na_2CO_3$ 浓溶液,可以将其转化成 $PbCO_3$
答案:
解析:选D。根据沉淀溶解平衡,$K_{sp}({PbCO_{3}})=c({Pb^{2+}})\cdot c({CO^{2-}_{3}})$,$K_{sp}({PbI_{2}})=c({Pb^{2+}})\cdot c^{2}({I^{-}})$,设$-\lg c({Pb^{2+}})=y$,$-\lg c({I^{-}})=x_{1}$,$-\lg c({CO^{2-}_{3}})=x_{2}$,则$y+2x_{1}=-\lg K_{sp}({PbI_{2}})$,$y+x_{2}=-\lg K_{sp}({PbCO_{3}})$,由斜率可知曲线Ⅰ表示${PbI_{2}}$的溶解平衡,曲线Ⅱ表示${PbCO_{3}}$的溶解平衡,故A错误;由b点数据可知,$K_{sp}({PbCO_{3}})=10^{-7}× 10^{-7}=10^{-14}$,由c点数据可知,$K_{sp}({PbI_{2}})=10^{-3}×(10^{-3})^{2}=10^{-9}$,$K_{sp}({PbI_{2}}):K_{sp}({PbCO_{3}})=10^{5}$,故B错误;b点与d点的$K_{sp}$相等,而改变温度会改变$K_{sp}$,故C错误;${PbI_{2}(s) +CO^{2-}_{3}(aq)\longrightleftharpoons PbCO_{3}(s) +2I^{-}(aq)}$ $K=\dfrac{K_{sp}({PbI_{2}})}{K_{sp}({PbCO_{3}})}=10^{5}$,向${PbI_{2}}$的悬浊液中加入${Na_{2}CO_{3}}$浓溶液,可以将其转化成${PbCO_{3}}$,故D正确。
3. (2025·邯郸高二质检) 饱和 $BaCO_3$ 溶液中,$c^2(Ba^{2+})$ 随 $c(OH^-)$ 而变化,在 $298 K$ 温度下,$c^2(Ba^{2+})$ 与 $c(OH^-)$ 关系如下图所示。下列说法错误的是(
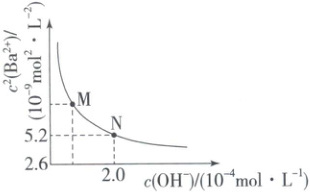
A.$BaCO_3$ 的溶度积 $K_{sp}(BaCO_3) = 2.6 × 10^{-9}$
B.若忽略 $CO_3^{2-}$ 的第二步水解,则 $K_{a2}(H_2CO_3) = 5.0 × 10^{-11}$
C.饱和 $BaCO_3$ 溶液中 $c(Ba^{2+})$ 随 $c(H^+)$ 增大而减小
D.$M$ 点溶液中:$c(Ba^{2+}) > c(HCO_3^{-}) > c(CO_3^{2-})$
C
)
A.$BaCO_3$ 的溶度积 $K_{sp}(BaCO_3) = 2.6 × 10^{-9}$
B.若忽略 $CO_3^{2-}$ 的第二步水解,则 $K_{a2}(H_2CO_3) = 5.0 × 10^{-11}$
C.饱和 $BaCO_3$ 溶液中 $c(Ba^{2+})$ 随 $c(H^+)$ 增大而减小
D.$M$ 点溶液中:$c(Ba^{2+}) > c(HCO_3^{-}) > c(CO_3^{2-})$
答案:
解析:选C。$c({OH^{-}})$越大,越抑制${CO^{2-}_{3}}$水解,可近似认为$c({Ba^{2+}})=c({CO^{2-}_{3}})$,由题图可知,$c({OH^{-}})$越大$c^{2}({Ba^{2+}})$越接近$2.6× 10^{-9}\ mol^{2}\cdotL^{-2}$,此时$K_{sp}=c({Ba^{2+}})\cdot c({CO^{2-}_{3}})=c^{2}({Ba^{2+}})=2.6× 10^{-9}$,A正确;若忽略${CO^{2-}_{3}}$的第二步水解,当$c({CO^{2-}_{3}})=c({HCO^{-}_{3}})$时,$K_{a2}({H_{2}CO_{3}})=\dfrac{c({CO^{2-}_{3}})\cdot c({H^{+}})}{c({HCO^{-}_{3}})}=c({H^{+}})$,$c({Ba^{2+}})=c({CO^{2-}_{3}})+c({HCO^{-}_{3}})=2c({CO^{2-}_{3}})$,$c^{2}({Ba^{2+}})=c({Ba^{2+}})× 2c({CO^{2-}_{3}})=2K_{sp}({BaCO_{3}})=5.2× 10^{-9}\ mol^{2}\cdotL^{-2}$,即N点,此时$c({OH^{-}})=2.0× 10^{-4}\ mol\cdotL^{-1}$,$c({H^{+}})=\dfrac{1.0× 10^{-14}}{2.0× 10^{-4}}\ mol\cdotL^{-1}=5.0× 10^{-11}\ mol\cdotL^{-1}$,$K_{a2}({H_{2}CO_{3}})=5.0× 10^{-11}$,B正确;由题图可知,$c^{2}({Ba^{2+}})$随$c({OH^{-}})$增大而减小,所以$c({Ba^{2+}})$随$c({H^{+}})$增大而增大,C错误;由B项分析可知,在N点,$c({CO^{2-}_{3}})=c({HCO^{-}_{3}})$,M点$c({OH^{-}})$小,$c({H^{+}})$大,所以更促进${CO^{2-}_{3}}$转化成${HCO^{-}_{3}}$,因此有$c({Ba^{2+}})>c({HCO^{-}_{3}})>c({CO^{2-}_{3}})$,D正确。
4. (2023·全国甲卷) 下图为 $Fe(OH)_3$、$Al(OH)_3$ 和 $Cu(OH)_2$ 在水中达到沉淀溶解平衡时的 $pM-pH$ 关系图 $\{ pM = -\lg [c(M) / (mol \cdot L^{-1})] $;$c(M) \leq 10^{-5} mol \cdot L^{-1}$ 可认为 $M$ 离子沉淀完全 $\}$。下列叙述正确的是(
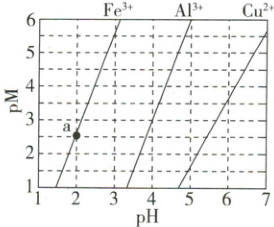
A.由 $a$ 点可求得 $K_{sp}[Fe(OH)_3] = 10^{-8.5}$
B.$pH = 4$ 时 $Al(OH)_3$ 的溶解度为 $\frac{10^{-10}}{3} mol \cdot L^{-1}$
C.浓度均为 $0.01 mol \cdot L^{-1}$ 的 $Al^{3+}$ 和 $Fe^{3+}$ 可通过分步沉淀进行分离
D.$Al^{3+}$、$Cu^{2+}$ 混合溶液中 $c(Cu^{2+}) = 0.2 mol \cdot L^{-1}$ 时二者不会同时沉淀
C
)
A.由 $a$ 点可求得 $K_{sp}[Fe(OH)_3] = 10^{-8.5}$
B.$pH = 4$ 时 $Al(OH)_3$ 的溶解度为 $\frac{10^{-10}}{3} mol \cdot L^{-1}$
C.浓度均为 $0.01 mol \cdot L^{-1}$ 的 $Al^{3+}$ 和 $Fe^{3+}$ 可通过分步沉淀进行分离
D.$Al^{3+}$、$Cu^{2+}$ 混合溶液中 $c(Cu^{2+}) = 0.2 mol \cdot L^{-1}$ 时二者不会同时沉淀
答案:
解析:选C。a点${pH}=2$、$pM=2.5$,$K_{sp}[{Fe(OH)_{3}}]=c({Fe^{3+}})\cdot c^{3}({OH^{-}})=10^{-2.5}×(10^{-12})^{3}=10^{-38.5}$,A错误;${pH}=4$时${Al^{3+}}$对应的$pM=3$,即$c({Al^{3+}})=10^{-3}\ mol\cdotL^{-1}$,故${Al(OH)_{3}}$的溶解度为$10^{-3}\ mol\cdotL^{-1}$,B错误;由题图可知,$c({Fe^{3+}})=10^{-5}\ mol\cdotL^{-1}$时的${pH}$小于$c({Al^{3+}})=0.01\ mol\cdotL^{-1}$时的${pH}$,故可通过调${pH}$分步沉淀浓度均为$0.01\ mol\cdotL^{-1}$的${Al^{3+}}$和${Fe^{3+}}$,C正确;由题图可知,$c({Al^{3+}})=10^{-5}\ mol\cdotL^{-1}$时(此时${Al^{3+}}$已完全沉淀),${pH}$约为4.7,此时$c({Cu^{2+}})=0.1\ mol\cdotL^{-1}<0.2\ mol\cdotL^{-1}$,即${Cu^{2+}}$已开始沉淀,故${Cu^{2+}}$、${Al^{3+}}$会同时沉淀,D错误。
查看更多完整答案,请扫码查看


