2025年新坐标同步练习高中化学选择性必修第一册人教版青海专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新坐标同步练习高中化学选择性必修第一册人教版青海专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第100页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
学思用 1. $AgCl$的电离方程式如何书写?
AgCl是强电解质,溶于水的AgCl完全电离:AgCl——Ag⁺+Cl⁻。
答案:
AgCl是强电解质,溶于水的AgCl完全电离:AgCl——Ag⁺+Cl⁻。
3. 沉淀溶解平衡的特征
动——动态平衡,溶解速率和沉淀速率②
等——达到平衡状态时,溶解速率和沉淀速率③
定——达到平衡状态时,溶液中的各离子浓度④
变——当改变外界条件时,沉淀溶解平衡可能发生移动
动——动态平衡,溶解速率和沉淀速率②
不等于
0等——达到平衡状态时,溶解速率和沉淀速率③
相等
定——达到平衡状态时,溶液中的各离子浓度④
保持不变
变——当改变外界条件时,沉淀溶解平衡可能发生移动
答案:
不等于;相等;保持不变
4. 沉淀溶解平衡的影响因素
(1)内因:难溶电解质本身的性质。
(2)外因:温度、浓度、同离子效应等,其影响符合勒夏特列原理。
①温度:一般来说,温度升高,平衡向沉淀溶解的方向移动。极少数难溶电解质的平衡移动方向与之相反,如⑤
②同离子效应:加入与难溶电解质电离出的离子相同的可溶性盐,平衡向生成沉淀的方向移动,溶解度减小。
③化学反应(反应离子):加入与难溶电解质电离出的离子发生反应的其他物质,平衡向沉淀溶解的方向移动,溶解度增大。
(1)内因:难溶电解质本身的性质。
(2)外因:温度、浓度、同离子效应等,其影响符合勒夏特列原理。
①温度:一般来说,温度升高,平衡向沉淀溶解的方向移动。极少数难溶电解质的平衡移动方向与之相反,如⑤
Ca(OH)₂
。②同离子效应:加入与难溶电解质电离出的离子相同的可溶性盐,平衡向生成沉淀的方向移动,溶解度减小。
③化学反应(反应离子):加入与难溶电解质电离出的离子发生反应的其他物质,平衡向沉淀溶解的方向移动,溶解度增大。
答案:
Ca(OH)₂
学思用 2. 以$AgCl(s){<=>}Ag^+(aq)+Cl^-(aq)$ $\Delta H>0$为例,分析填表。
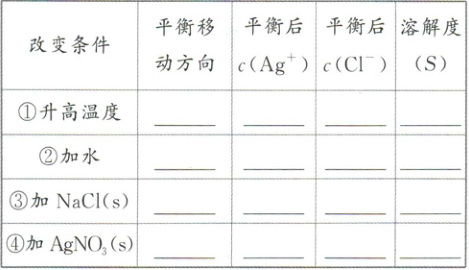

①右移 增大 增大 增大 ②右移 不变 不变 不变 ③左移 减小 增大 减小 ④左移 增大 减小 减小
答案:
①右移 增大 增大 增大 ②右移 不变 不变 不变 ③左移 减小 增大 减小 ④左移 增大 减小 减小
自我诊断
(1)沉淀达到溶解平衡时,溶液中难溶电解质电离出的各种离子浓度均相等 (
(2)$AgCl$达到沉淀溶解平衡时,$v(溶解)= v(沉淀)$,$c(Ag^+)和c(Cl^-)$均保持不变 (
(3)升高温度,沉淀溶解平衡一定正向移动 (
(4)室温下,$AgCl$在水中的溶解度小于在食盐水中的溶解度 (
(5)常温下,向$BaCO_3的饱和溶液中加入Na_2CO_3$固体,有$BaCO_3$生成 (
(1)沉淀达到溶解平衡时,溶液中难溶电解质电离出的各种离子浓度均相等 (
×
)(2)$AgCl$达到沉淀溶解平衡时,$v(溶解)= v(沉淀)$,$c(Ag^+)和c(Cl^-)$均保持不变 (
√
)(3)升高温度,沉淀溶解平衡一定正向移动 (
×
)(4)室温下,$AgCl$在水中的溶解度小于在食盐水中的溶解度 (
×
)(5)常温下,向$BaCO_3的饱和溶液中加入Na_2CO_3$固体,有$BaCO_3$生成 (
√
)
答案:
(1)×
(2)√
(3)×
(4)×
(5)√
(1)×
(2)√
(3)×
(4)×
(5)√
1. (教材习题改编)难溶电解质在水中达到沉淀溶解平衡时,下列说法错误的是 (
A.沉淀和溶解的速率相等
B.难溶电解质在水中形成饱和溶液
C.再加入难溶电解质,溶液中各离子的浓度保持不变
D.$BaSO_4$属于难溶电解质,在水中完全不能溶解
D
)A.沉淀和溶解的速率相等
B.难溶电解质在水中形成饱和溶液
C.再加入难溶电解质,溶液中各离子的浓度保持不变
D.$BaSO_4$属于难溶电解质,在水中完全不能溶解
答案:
D
2. 在平衡体系$Ca(OH)_2(s){<=>}Ca^{2+}(aq)+2OH^-(aq)$ $\Delta H<0$中,下列操作能使$c(Ca^{2+})$减小,而使$c(OH^-)$增大的是 (
A.加入少量$CuCl_2$固体
B.加入少量$NaCl$固体
C.加入少量$K_2CO_3$固体
D.升高体系温度
C
)A.加入少量$CuCl_2$固体
B.加入少量$NaCl$固体
C.加入少量$K_2CO_3$固体
D.升高体系温度
答案:
C
3. (2025•北京海淀区高二统考)将等浓度等体积的$AgNO_3溶液与KI$溶液混合,充分反应后静置,关于$AgI$的沉淀溶解平衡与相关离子浓度,下列说法不正确的是 (
A.加入少量蒸馏水,平衡向溶解方向移动,$c(Ag^+)$增大
B.加入少量$AgI$固体,沉淀溶解平衡不移动
C.加入少量$Na_2S$固体,平衡向溶解方向移动,$c(I^-)$增大
D.继续加入$KI$固体,平衡向沉淀方向移动,$c(Ag^+)$减小
A
)A.加入少量蒸馏水,平衡向溶解方向移动,$c(Ag^+)$增大
B.加入少量$AgI$固体,沉淀溶解平衡不移动
C.加入少量$Na_2S$固体,平衡向溶解方向移动,$c(I^-)$增大
D.继续加入$KI$固体,平衡向沉淀方向移动,$c(Ag^+)$减小
答案:
A
查看更多完整答案,请扫码查看


