第45页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
1. 以钠原子的原子结构示意图为例,在横线上写出其意义。


答案:
【解析】:
本题考查对钠原子结构示意图的认识。在原子结构示意图中,圆圈内的数字表示质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离核最远的电子层为最外层。
对于钠原子结构示意图,圆圈内数字“11”代表钠原子的质子数为11;数字“2”所在的弧线表示第一层电子层,该层电子数为2;数字“8”所在的弧线表示第二层电子层,该层电子数为8;数字“1”所在的弧线表示第三层电子层,也是最外层,该层电子数为1。
【答案】:
①原子核内质子数为11(或质子数为11);
②第一层电子层上有2个电子;
③第二层电子层上有8个电子;
④第三层电子层上有1个电子;
⑤最外层电子数为1。
本题考查对钠原子结构示意图的认识。在原子结构示意图中,圆圈内的数字表示质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离核最远的电子层为最外层。
对于钠原子结构示意图,圆圈内数字“11”代表钠原子的质子数为11;数字“2”所在的弧线表示第一层电子层,该层电子数为2;数字“8”所在的弧线表示第二层电子层,该层电子数为8;数字“1”所在的弧线表示第三层电子层,也是最外层,该层电子数为1。
【答案】:
①原子核内质子数为11(或质子数为11);
②第一层电子层上有2个电子;
③第二层电子层上有8个电子;
④第三层电子层上有1个电子;
⑤最外层电子数为1。
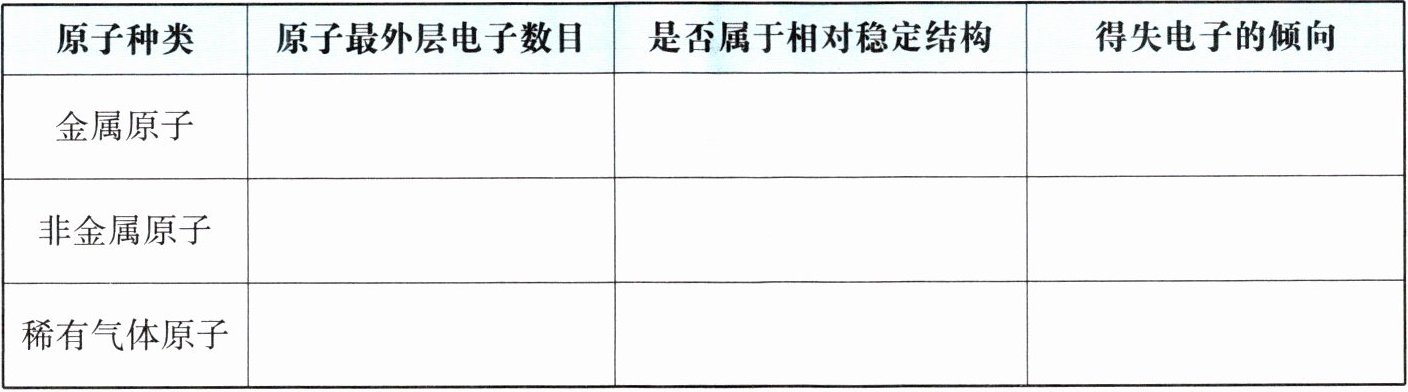
2. 结合课本相关内容,归纳金属原子、非金属原子、稀有气体原子的核外电子排布(特别是最外层电子数目)的特点。
|原子种类|原子最外层电子数目|是否属于相对稳定结构|得失电子的倾向|
|金属原子|______|______|______|
|非金属原子|______|______|______|
|稀有气体原子|______|______|______|
|原子种类|原子最外层电子数目|是否属于相对稳定结构|得失电子的倾向|
|金属原子|______|______|______|
|非金属原子|______|______|______|
|稀有气体原子|______|______|______|

答案:
【解析】:
本题考查金属原子、非金属原子、稀有气体原子核外电子排布特点,特别是最外层电子数目,以及是否属于相对稳定结构和得失电子的倾向。
金属原子最外层电子数一般小于4,在化学反应中易失去电子,形成相对稳定结构,所以不属于相对稳定结构;
非金属原子最外层电子数一般大于或等于4,在化学反应中易得到电子,形成相对稳定结构,所以不属于相对稳定结构;
稀有气体原子最外层电子数一般为8(氦为2),达到了相对稳定结构,不易得失电子。
【答案】:
|原子种类|原子最外层电子数目|是否属于相对稳定结构|得失电子的倾向|
| ---- | ---- | ---- | ---- |
|金属原子|小于4|否|易失去电子|
|非金属原子|大于或等于4|否|易得到电子|
|稀有气体原子|8(氦为2)|是|不易得失电子|
本题考查金属原子、非金属原子、稀有气体原子核外电子排布特点,特别是最外层电子数目,以及是否属于相对稳定结构和得失电子的倾向。
金属原子最外层电子数一般小于4,在化学反应中易失去电子,形成相对稳定结构,所以不属于相对稳定结构;
非金属原子最外层电子数一般大于或等于4,在化学反应中易得到电子,形成相对稳定结构,所以不属于相对稳定结构;
稀有气体原子最外层电子数一般为8(氦为2),达到了相对稳定结构,不易得失电子。
【答案】:
|原子种类|原子最外层电子数目|是否属于相对稳定结构|得失电子的倾向|
| ---- | ---- | ---- | ---- |
|金属原子|小于4|否|易失去电子|
|非金属原子|大于或等于4|否|易得到电子|
|稀有气体原子|8(氦为2)|是|不易得失电子|
以钠与氯气的反应为例,当燃着的钠和氯气相遇时,氯气的分子($Cl_2$)分开成单个的氯原子($Cl$),与钠原子($Na$)发生了如下变化:

1. 氯化钠是由______和______通过静电作用结合而成。
2. 原子与其所形成的离子相比,______数相同,______数不同。

1. 氯化钠是由______和______通过静电作用结合而成。
2. 原子与其所形成的离子相比,______数相同,______数不同。
答案:
【解析】:
(1)本题可根据氯化钠的构成以及离子化合物的形成过程来进行分析。从图中可以看出,钠原子失去电子形成钠离子,氯原子得到电子形成氯离子,钠离子和氯离子通过静电作用结合形成氯化钠。
(2)原子通过得失电子形成离子,在这个过程中,质子数不变,因为质子数决定了元素的种类;而电子数发生了变化,得电子后电子数增多,失电子后电子数减少。
【答案】:
(1)钠离子(或$Na^+$);氯离子(或$Cl^-$)
(2)质子;电子
(1)本题可根据氯化钠的构成以及离子化合物的形成过程来进行分析。从图中可以看出,钠原子失去电子形成钠离子,氯原子得到电子形成氯离子,钠离子和氯离子通过静电作用结合形成氯化钠。
(2)原子通过得失电子形成离子,在这个过程中,质子数不变,因为质子数决定了元素的种类;而电子数发生了变化,得电子后电子数增多,失电子后电子数减少。
【答案】:
(1)钠离子(或$Na^+$);氯离子(或$Cl^-$)
(2)质子;电子
查看更多完整答案,请扫码查看


