第11页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
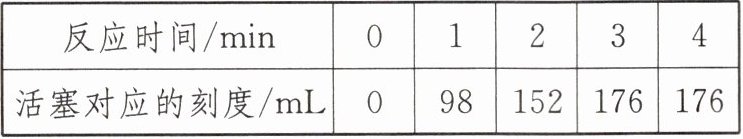
18. 小科用如图所示的装置来测量某石灰石样品中碳酸钙的质量分数,注射器水平放置,夹持装置未画出。他在试管中加入1 g石灰石样品和足量的稀盐酸(石灰石中其他成分不与稀盐酸反应产生气体),快速将连有注射器的橡皮塞塞紧试管口,实验结果如表所示。(忽略活塞与筒壁之间的摩擦及温度变化对实验的影响)
(实验装置图:试管内有稀盐酸和石灰石,连接注射器)

|反应时间/min|0|1|2|3|4|
|活塞对应的刻度/mL|0|98|152|176|176|
(1)实验中判断石灰石和盐酸反应完的依据是______。
(2)当时实验条件下二氧化碳的密度约为2 g/L。请利用表格中的数据,根据化学方程式计算该石灰石样品中碳酸钙的质量分数。
(实验装置图:试管内有稀盐酸和石灰石,连接注射器)

|反应时间/min|0|1|2|3|4|
|活塞对应的刻度/mL|0|98|152|176|176|

(1)实验中判断石灰石和盐酸反应完的依据是______。
(2)当时实验条件下二氧化碳的密度约为2 g/L。请利用表格中的数据,根据化学方程式计算该石灰石样品中碳酸钙的质量分数。
答案:
(1)注射器活塞对应的刻度不再变化
(2)解:由表可知,生成二氧化碳的体积为176 mL=0.176 L
二氧化碳的质量=0.176 L×2 g/L=0.352 g
设石灰石样品中碳酸钙的质量为x
CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑
100 44
x 0.352 g
100/44=x/0.352 g
x=0.8 g
碳酸钙的质量分数=0.8 g/1 g×100%=80%
答:该石灰石样品中碳酸钙的质量分数为80%。
(1)注射器活塞对应的刻度不再变化
(2)解:由表可知,生成二氧化碳的体积为176 mL=0.176 L
二氧化碳的质量=0.176 L×2 g/L=0.352 g
设石灰石样品中碳酸钙的质量为x
CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑
100 44
x 0.352 g
100/44=x/0.352 g
x=0.8 g
碳酸钙的质量分数=0.8 g/1 g×100%=80%
答:该石灰石样品中碳酸钙的质量分数为80%。
19. 侯氏制碱法得到的纯碱($Na_2CO_3$)产品中常含有少量氯化钠杂质。实验中取30 g纯碱样品,平均分成五份(每份6 g),依次加入盛有100 g稀盐酸的锥形瓶中(锥形瓶的质量为60 g),每次充分反应后都进行称量,得到的实验数据如表所示(假设反应产生的气体全部逸出,其他物质的挥发忽略不计)。
[提示]$Na_2CO_3 + 2HCl= 2NaCl + H_2O + CO_2↑$。
|加入纯碱样品的质量/g|电子天平的示数/g|
|第一次|6|163.8|
|第二次|6|167.6|
|第三次|6|171.4|
|第四次|6|177.4|
|第五次|6|183.4|

(1)请问第三次加入纯碱样品时,是否还能发生化学反应?______。
(2)列式计算纯碱样品中碳酸钠的质量分数。(计算结果精确到0.1%)
[提示]$Na_2CO_3 + 2HCl= 2NaCl + H_2O + CO_2↑$。
|加入纯碱样品的质量/g|电子天平的示数/g|
|第一次|6|163.8|
|第二次|6|167.6|
|第三次|6|171.4|
|第四次|6|177.4|
|第五次|6|183.4|

(1)请问第三次加入纯碱样品时,是否还能发生化学反应?______。
(2)列式计算纯碱样品中碳酸钠的质量分数。(计算结果精确到0.1%)
答案:
(1)是
(2)解:设每份6g纯碱样品中碳酸钠的质量为x。
第一次加入6g样品后,总质量为60g+100g+6g=166g,产生CO₂的质量为166g-163.8g=2.2g。
Na₂CO₃+2HCl=2NaCl+H₂O+CO₂↑
106 44
x 2.2g
106/44=x/2.2g
x=5.3g
纯碱样品中碳酸钠的质量分数为5.3g/6g×100%≈88.3%
答:纯碱样品中碳酸钠的质量分数为88.3%。
(1)是
(2)解:设每份6g纯碱样品中碳酸钠的质量为x。
第一次加入6g样品后,总质量为60g+100g+6g=166g,产生CO₂的质量为166g-163.8g=2.2g。
Na₂CO₃+2HCl=2NaCl+H₂O+CO₂↑
106 44
x 2.2g
106/44=x/2.2g
x=5.3g
纯碱样品中碳酸钠的质量分数为5.3g/6g×100%≈88.3%
答:纯碱样品中碳酸钠的质量分数为88.3%。
查看更多完整答案,请扫码查看


