第57页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
6. 取某可燃物$6.4\ g$,使其充分燃烧,测得生成二氧化碳$8.8\ g$、水$7.2\ g$。试求:
(1)该可燃物含有的元素质量各为多少克?
(2)若该可燃物的相对分子质量为32,则该可燃物的化学式为
(1)该可燃物含有的元素质量各为多少克?
含碳元素2.4 g,氢元素0.8 g,氧元素3.2 g
。(2)若该可燃物的相对分子质量为32,则该可燃物的化学式为
CH₂O
。
答案:
(1)含碳元素2.4 g,氢元素0.8 g,氧元素3.2 g
(2)CH₂O
(1)含碳元素2.4 g,氢元素0.8 g,氧元素3.2 g
(2)CH₂O
7.[传统文化情境]央视栏目《典籍里的中国》展现了中国智慧,其中有许多古今对比。
(1)净水——明代《天工开物》一书记载了明矾净水,如今使用高铁酸钾(${K2FeO4}$)不仅能净水,还能消毒,涉及的化学方程式为${4K2FeO4 + 10X\xlongequal{}4Fe(OH)3↓ + 8KOH + 3O2↑}$,则X的化学式为
(2)冶金——我国古代就发明了湿法冶金技术,如今人们掌握了多种金属的冶炼技术。冶炼金属钛的其中一步反应为${5TiO2 + 6C + 10Cl2\xlongequal{600℃}5TiCl4 + 2X + 4CO2}$,则X的化学式为
(1)净水——明代《天工开物》一书记载了明矾净水,如今使用高铁酸钾(${K2FeO4}$)不仅能净水,还能消毒,涉及的化学方程式为${4K2FeO4 + 10X\xlongequal{}4Fe(OH)3↓ + 8KOH + 3O2↑}$,则X的化学式为
H₂O
。(2)冶金——我国古代就发明了湿法冶金技术,如今人们掌握了多种金属的冶炼技术。冶炼金属钛的其中一步反应为${5TiO2 + 6C + 10Cl2\xlongequal{600℃}5TiCl4 + 2X + 4CO2}$,则X的化学式为
CO
。
答案:
(1)H₂O
(2)CO
(1)H₂O
(2)CO
8. 中国计划在2060年前实现“碳中和”,彰显了大国担当。资源化利用${CO2}$是实现“碳中和”的重要途径。如图5-T-3是${CO2}$转化为甲醇(${CH3OH}$)的微观示意图,请回答下列问题。
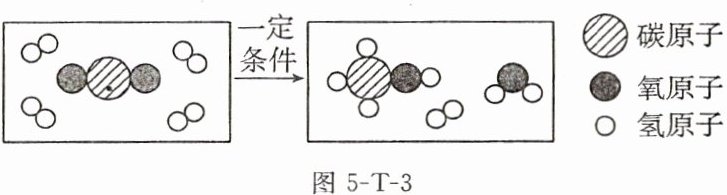
(1)该反应前后共有
(2)写出该反应的化学方程式:
(3)参加反应的${CO2}和{H2}$的质量比为
(4)该反应中发生变化的粒子是

(1)该反应前后共有
三
种化合物。(2)写出该反应的化学方程式:
3H₂+CO₂$\frac{\underline{\;一定条件\;}}{\;}$CH₃OH+H₂O
。(3)参加反应的${CO2}和{H2}$的质量比为
22:3
(填最简整数比)。(4)该反应中发生变化的粒子是
分子
(填“分子”或“原子”)。
答案:
(1)三
(2)3H₂+CO₂$\frac{\underline{\;一定条件\;}}{\;}$CH₃OH+H₂O
(3)22:3
(4)分子
(1)三
(2)3H₂+CO₂$\frac{\underline{\;一定条件\;}}{\;}$CH₃OH+H₂O
(3)22:3
(4)分子
9. 下面是探究质量守恒定律的一些典型实验。
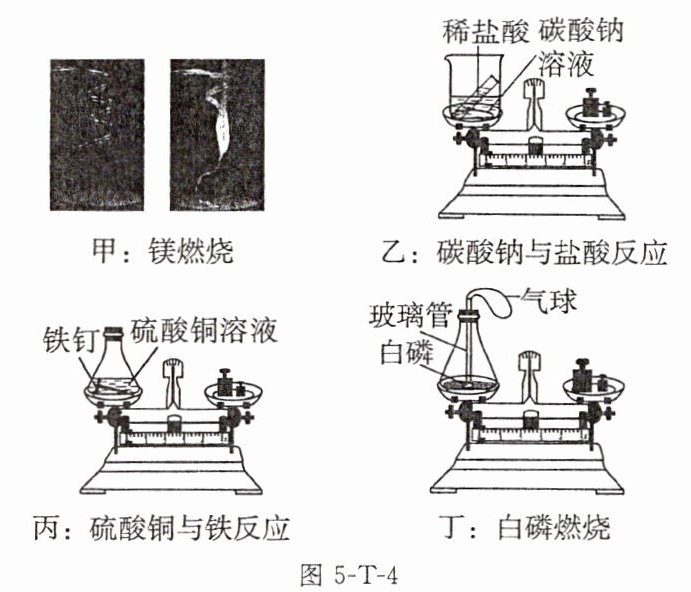
已知:碳酸钠溶液和稀盐酸反应生成氯化钠、水和二氧化碳气体;硫酸铜溶液和铁钉反应生成硫酸亚铁溶液和铜。
(1)用实验甲来探究质量守恒定律,镁完全燃烧后,称量陶土网上留下固体的质量比反应前镁的质量还轻(只考虑氧气参加反应),联系实验过程,分析其原因:______。
(2)实验乙中反应前托盘天平平衡,然后将稀盐酸倒入烧杯中与碳酸钠充分反应后,再称量,观察到托盘天平不平衡,该反应______(填“遵守”或“不遵守”)质量守恒定律,反应后托盘天平不平衡的原因是______。
(3)实验丁中白磷燃烧的化学方程式为______,此实验对白磷的用量______(填“有”或“无”)要求;实验过程中气球的变化是______,如果将白磷直接放在锥形瓶底部,可能造成的后果是______;白磷充分燃烧后冷却,将装置放回托盘天平的左盘,托盘天平______(填“平衡”或“不平衡”);能够验证质量守恒定律的现象是______。
(4)写出上述实验中既没有气体参加,也没有气体生成的实验原理的化学方程式:______,该实验的实验装置是______(填“开放体系”或“密闭体系”)。

已知:碳酸钠溶液和稀盐酸反应生成氯化钠、水和二氧化碳气体;硫酸铜溶液和铁钉反应生成硫酸亚铁溶液和铜。
(1)用实验甲来探究质量守恒定律,镁完全燃烧后,称量陶土网上留下固体的质量比反应前镁的质量还轻(只考虑氧气参加反应),联系实验过程,分析其原因:______。
(2)实验乙中反应前托盘天平平衡,然后将稀盐酸倒入烧杯中与碳酸钠充分反应后,再称量,观察到托盘天平不平衡,该反应______(填“遵守”或“不遵守”)质量守恒定律,反应后托盘天平不平衡的原因是______。
(3)实验丁中白磷燃烧的化学方程式为______,此实验对白磷的用量______(填“有”或“无”)要求;实验过程中气球的变化是______,如果将白磷直接放在锥形瓶底部,可能造成的后果是______;白磷充分燃烧后冷却,将装置放回托盘天平的左盘,托盘天平______(填“平衡”或“不平衡”);能够验证质量守恒定律的现象是______。
(4)写出上述实验中既没有气体参加,也没有气体生成的实验原理的化学方程式:______,该实验的实验装置是______(填“开放体系”或“密闭体系”)。
答案:
(1)镁燃烧时产生大量的白烟,白烟有很大一部分向上,且坩埚钳上也沾有一部分白色固体,故固体的质量会减少(合理即可)
(2)遵守 反应生成的二氧化碳逸出装置,未被称量
(3)4P+5O₂$\frac{\underline{\;点燃\;}}{\;}$2P₂O₅ 无 先膨胀后缩小 锥形瓶炸裂
平衡 白磷充分燃烧后冷却,将装置放回托盘天平的左盘,托盘天平仍然平衡
(4)Fe+CuSO₄$\xlongequal{\;\;}$FeSO₄+Cu 密闭体系
(1)镁燃烧时产生大量的白烟,白烟有很大一部分向上,且坩埚钳上也沾有一部分白色固体,故固体的质量会减少(合理即可)
(2)遵守 反应生成的二氧化碳逸出装置,未被称量
(3)4P+5O₂$\frac{\underline{\;点燃\;}}{\;}$2P₂O₅ 无 先膨胀后缩小 锥形瓶炸裂
平衡 白磷充分燃烧后冷却,将装置放回托盘天平的左盘,托盘天平仍然平衡
(4)Fe+CuSO₄$\xlongequal{\;\;}$FeSO₄+Cu 密闭体系
查看更多完整答案,请扫码查看


