第54页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
6. 化学语言包括文字语言、符号语言、图表语言等。化学反应通常通过化学方程式来表示,写出下列反应的化学方程式。
(1)碳单质包括金刚石、石墨和${C_{60}}$等,它们的化学性质相似。写出石墨在空气中完全燃烧的化学方程式:
(2)${CO_{2}}$在空气中含量增多会加剧温室效应,科学家研究得出,可以利用二氧化碳和氨气(${NH_{3}}$)在一定条件下反应生成化学肥料尿素[${CO(NH_{2})_{2}}$]和水,既能缓解温室效应,也能给庄稼提供氮肥。写出反应的化学方程式:
(1)碳单质包括金刚石、石墨和${C_{60}}$等,它们的化学性质相似。写出石墨在空气中完全燃烧的化学方程式:
C+O₂$\frac{\underline{\;点燃\;}}{}$CO₂
。(2)${CO_{2}}$在空气中含量增多会加剧温室效应,科学家研究得出,可以利用二氧化碳和氨气(${NH_{3}}$)在一定条件下反应生成化学肥料尿素[${CO(NH_{2})_{2}}$]和水,既能缓解温室效应,也能给庄稼提供氮肥。写出反应的化学方程式:
CO₂+2NH₃$\frac{\underline{\;一定条件\;}}{}$CO(NH₂)₂+H₂O
。
答案:
(1)C+O₂$\frac{\underline{\;点燃\;}}{}$CO₂
(2)CO₂+2NH₃$\frac{\underline{\;一定条件\;}}{}$CO(NH₂)₂+H₂O
(1)C+O₂$\frac{\underline{\;点燃\;}}{}$CO₂
(2)CO₂+2NH₃$\frac{\underline{\;一定条件\;}}{}$CO(NH₂)₂+H₂O
7. (2024威海)某品牌“发热鞋垫”中发热剂的主要成分为铁粉、活性炭和氯化钠等。为测定其中铁粉的含量,小明同学进行如下实验:取5g发热剂样品于烧杯中,逐滴加入稀硫酸至不再产生气泡,测得加入稀硫酸的质量为23.4g,反应后烧杯内剩余物的总质量为28.3g,计算发热剂中铁粉的质量分数。(假设其他成分不与酸反应,铁与稀硫酸反应的化学方程式为${Fe + H_{2}SO_{4}\xlongequal{}FeSO_{4} + H_{2}\uparrow}$)
【思路导引】
(1)利用质量守恒定律,反应前物质
(2)根据化学方程式计算参加反应的铁粉的质量,进而计算出发热剂中铁粉的质量分数。将计算过程写在下面。
【思路导引】
(1)利用质量守恒定律,反应前物质
发热剂
与稀硫酸
的质量共28.4
g,反应后烧杯内剩余物质的质量为28.3g,质量减少0.1
g,减少的质量为生成的氢气
的质量。(2)根据化学方程式计算参加反应的铁粉的质量,进而计算出发热剂中铁粉的质量分数。将计算过程写在下面。
解:铁和稀硫酸反应生成氢气的质量为5g+23.4g-28.3g=0.1g。设5g发热剂中铁粉的质量为x。Fe+H₂SO₄=FeSO₄+H₂↑56 2x 0.1g$\frac{56}{2}$=$\frac{x}{0.1g}$ x=2.8g发热剂中铁粉的质量分数为$\frac{2.8g}{5g}$×100%=56%。答:发热剂中铁粉的质量分数为56%。
答案:
(1)发热剂 稀硫酸 28.4 0.1 氢气
(2)解:铁和稀硫酸反应生成氢气的质量为5g+23.4g-28.3g=0.1g。设5g发热剂中铁粉的质量为x。Fe+H₂SO₄=FeSO₄+H₂↑56 2x 0.1g$\frac{56}{2}$=$\frac{x}{0.1g}$ x=2.8g发热剂中铁粉的质量分数为$\frac{2.8g}{5g}$×100%=56%。答:发热剂中铁粉的质量分数为56%。
(1)发热剂 稀硫酸 28.4 0.1 氢气
(2)解:铁和稀硫酸反应生成氢气的质量为5g+23.4g-28.3g=0.1g。设5g发热剂中铁粉的质量为x。Fe+H₂SO₄=FeSO₄+H₂↑56 2x 0.1g$\frac{56}{2}$=$\frac{x}{0.1g}$ x=2.8g发热剂中铁粉的质量分数为$\frac{2.8g}{5g}$×100%=56%。答:发热剂中铁粉的质量分数为56%。
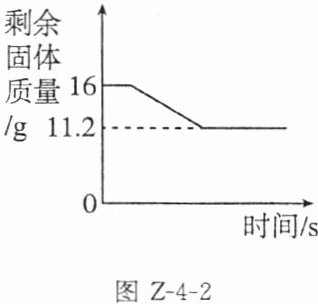
8. (2023赤峰)某校实验室工作人员欲测定某氯酸钾样品中氯酸钾的质量分数,现取14g该样品与2g二氧化锰混合,放入试管中充分加热(杂质不发生反应),反应过程和数据如图Z-4-2所示。请计算:
(1)生成氧气的质量为______g。
(2)该样品中氯酸钾的质量分数。(写出计算过程)
(1)生成氧气的质量为
(2)
(1)生成氧气的质量为______g。
(2)该样品中氯酸钾的质量分数。(写出计算过程)

(1)生成氧气的质量为
4.8
g。(2)
解:设14g该样品中氯酸钾的质量为x。2KClO₃$\frac{\underline{MnO_2}}{\triangle}$2KCl+3O₂↑245 96x 4.8g$\frac{245}{96}$=$\frac{x}{4.8g}$ x=12.25g该样品中氯酸钾的质量分数为$\frac{12.25g}{14g}$×100%=87.5%。答:该样品中氯酸钾的质量分数为87.5%。
答案:
(1)4.8
(2)解:设14g该样品中氯酸钾的质量为x。2KClO₃$\frac{\underline{MnO_2}}{\triangle}$2KCl+3O₂↑245 96x 4.8g$\frac{245}{96}$=$\frac{x}{4.8g}$ x=12.25g该样品中氯酸钾的质量分数为$\frac{12.25g}{14g}$×100%=87.5%。答:该样品中氯酸钾的质量分数为87.5%。
(1)4.8
(2)解:设14g该样品中氯酸钾的质量为x。2KClO₃$\frac{\underline{MnO_2}}{\triangle}$2KCl+3O₂↑245 96x 4.8g$\frac{245}{96}$=$\frac{x}{4.8g}$ x=12.25g该样品中氯酸钾的质量分数为$\frac{12.25g}{14g}$×100%=87.5%。答:该样品中氯酸钾的质量分数为87.5%。
9. (2024陕西)学习小组用一瓶长久放置、标签标示溶质质量分数为5%的过氧化氢溶液制取氧气,并用如图Z-4-3所示方法测定实验产生氧气的质量。请完成下列分析及计算。
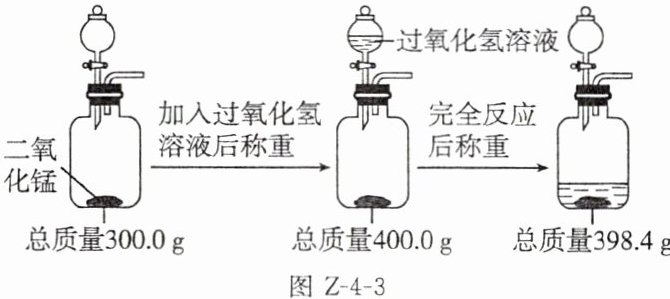
(1)二氧化锰在反应前后的质量
(2)实验产生氧气的质量是
(3)通过计算说明实验所用过氧化氢溶液的溶质质量分数与标签标示的5%是否一致。

(1)二氧化锰在反应前后的质量
不变
(填“变大”“变小”或“不变”)。(2)实验产生氧气的质量是
1.6
g。(3)通过计算说明实验所用过氧化氢溶液的溶质质量分数与标签标示的5%是否一致。
解:设参加反应的过氧化氢的质量为x。2H₂O₂$\frac{\underline{MnO_2}}{}$2H₂O+O₂↑68 32x 1.6g$\frac{68}{32}$=$\frac{x}{1.6g}$ x=3.4g则实验所用过氧化氢溶液的溶质质量分数为$\frac{3.4g}{400.0g-300.0g}$×100%=3.4%≠5%。答:实验所用过氧化氢溶液的溶质质量分数与标签标示的5%不一致。
答案:
(1)不变
(2)1.6
(3)解:设参加反应的过氧化氢的质量为x。2H₂O₂$\frac{\underline{MnO_2}}{}$2H₂O+O₂↑68 32x 1.6g$\frac{68}{32}$=$\frac{x}{1.6g}$ x=3.4g则实验所用过氧化氢溶液的溶质质量分数为$\frac{3.4g}{400.0g-300.0g}$×100%=3.4%≠5%。答:实验所用过氧化氢溶液的溶质质量分数与标签标示的5%不一致。
(1)不变
(2)1.6
(3)解:设参加反应的过氧化氢的质量为x。2H₂O₂$\frac{\underline{MnO_2}}{}$2H₂O+O₂↑68 32x 1.6g$\frac{68}{32}$=$\frac{x}{1.6g}$ x=3.4g则实验所用过氧化氢溶液的溶质质量分数为$\frac{3.4g}{400.0g-300.0g}$×100%=3.4%≠5%。答:实验所用过氧化氢溶液的溶质质量分数与标签标示的5%不一致。
查看更多完整答案,请扫码查看


