第74页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
8 (2023·盐城阜宁期末)在一个密闭容器中放入 M、N、P、Q 四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表:
|物质| M | N | P | Q |
|反应前质量/g| 18 | 1 | 2 | 32 |
|反应后质量/g| 待测 | 26 | 2 | 12 |
对该反应的认识正确的是(
A.M 可能是单质也可能是化合物,N 可能是单质
B.P 一定是该反应的催化剂
C.参加反应的 M 和 Q 的质量比是13:12
D.M、Q 两种物质中的元素种类一定与 N 物质中的元素种类相同
|物质| M | N | P | Q |
|反应前质量/g| 18 | 1 | 2 | 32 |
|反应后质量/g| 待测 | 26 | 2 | 12 |

对该反应的认识正确的是(
D
)。A.M 可能是单质也可能是化合物,N 可能是单质
B.P 一定是该反应的催化剂
C.参加反应的 M 和 Q 的质量比是13:12
D.M、Q 两种物质中的元素种类一定与 N 物质中的元素种类相同
答案:
D [解析]待测值=18+1+2+32-26-2-12=13,反应后M、Q质量减小,都是反应物,N的质量增大,是生成物,即M和Q反应生成N,M可能是单质也可能是化合物,N一定是化合物,A错误;P的质量不变,可能是该反应的催化剂,也可能没有参加反应,B错误;参加反应的M和Q的质量比是(18-13):(32-12)=1:4,C错误;M与Q反应生成N,因此M、Q两种物质中的元素种类一定与N物质中的元素种类相同,D正确。
9 乙醇不完全燃烧时可以产生一氧化碳、二氧化碳和水。依据下表数据分析得出的结论中,不正确的是(
|物质|乙醇|氧气|二氧化碳|水|一氧化碳|
|反应前质量/g|6.6|8.8|0|0|0|
|反应后质量/g|2|0|6.6|5.4|a|
A.表中的 a 为1.4
B.生成的${CO}和{CO_{2}}$分子个数比为1:3
C.在化学反应前后碳元素质量一定相等
D.参加反应的乙醇和氧气的质量比为3:4
D
)。|物质|乙醇|氧气|二氧化碳|水|一氧化碳|
|反应前质量/g|6.6|8.8|0|0|0|
|反应后质量/g|2|0|6.6|5.4|a|

A.表中的 a 为1.4
B.生成的${CO}和{CO_{2}}$分子个数比为1:3
C.在化学反应前后碳元素质量一定相等
D.参加反应的乙醇和氧气的质量比为3:4
答案:
D
10 根据测定白磷燃烧前后质量的变化情况的装置,试回答:
(1)白磷燃烧时可以观察到产生浓厚的
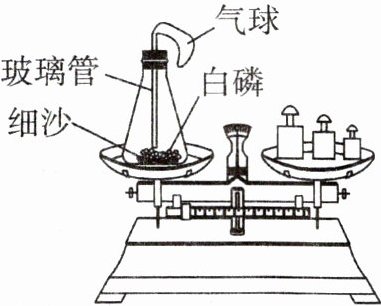
(2)待燃烧停止锥形瓶冷却后,将其放回原托盘上,天平是否仍平衡?
(3)如果反应前称得带塞锥形瓶总质量为 M,燃烧后当锥形瓶冷却到原温时,打开锥形瓶盖,直至瓶内气体的组成与反应前一样,再塞上瓶盖称得总质量为 N,则 M、N 的关系是
(4)由此可得到启示:用实验研究化学反应前后反应物与生成物之间的总质量关系时,必须在
(1)白磷燃烧时可以观察到产生浓厚的
白烟
。
(2)待燃烧停止锥形瓶冷却后,将其放回原托盘上,天平是否仍平衡?
平衡
,由此得到的结论是反应前后质量守恒
。(3)如果反应前称得带塞锥形瓶总质量为 M,燃烧后当锥形瓶冷却到原温时,打开锥形瓶盖,直至瓶内气体的组成与反应前一样,再塞上瓶盖称得总质量为 N,则 M、N 的关系是
N>M
,参加反应的氧气的质量是N-M
。(4)由此可得到启示:用实验研究化学反应前后反应物与生成物之间的总质量关系时,必须在
密闭
(填“密闭”或“敞开”)体系中进行。
答案:
(1)白烟
(2)平衡 反应前后质量守恒
(3)N>M N-M
(4)密闭
(1)白烟
(2)平衡 反应前后质量守恒
(3)N>M N-M
(4)密闭
11 某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的化学方程式:
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵循质量守恒定律。我
(3)小红按如图装置进行实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】①氧化镁为白色固体;
②镁与氮气反应生成黄色的氮化镁(${Mg_{3}N_{2}}$)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。

【做出猜想】黄色固体为${Mg_{3}N_{2}}$。
【实验探究】请设计实验,验证猜想。
|实验操作|实验现象及结论|
|
【反思与交流】空气中${N_{2}}的含量远大于{O_{2}}$的含量,而镁条在空气中燃烧生成的${MgO}却远多于{Mg_{3}N_{2}}$,为什么呢?请给出合理的解释:
(1)请写出镁条与氧气反应的化学方程式:
2Mg+O₂点燃2MgO
。(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵循质量守恒定律。我
不同意
(填“同意”或“不同意”)小明的观点,因为镁燃烧是镁与空气中的氧气等气体的反应
。(3)小红按如图装置进行实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】①氧化镁为白色固体;
②镁与氮气反应生成黄色的氮化镁(${Mg_{3}N_{2}}$)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。

【做出猜想】黄色固体为${Mg_{3}N_{2}}$。
【实验探究】请设计实验,验证猜想。
|实验操作|实验现象及结论|
|
取少量黄色固体于试管中,加入适量的水,并将湿润的红色石蕊试纸放在试管口
|试管中有气体产生,湿润的红色石蕊试纸变蓝,证明猜想正确
|
【反思与交流】空气中${N_{2}}的含量远大于{O_{2}}$的含量,而镁条在空气中燃烧生成的${MgO}却远多于{Mg_{3}N_{2}}$,为什么呢?请给出合理的解释:
O₂比N₂的化学性质活泼(合理即可)
。
答案:
(1)2Mg+O₂点燃2MgO
(2)不同意 镁燃烧是镁与空气中的氧气等气体的反应
(3)【实验探究】取少量黄色固体于试管中,加入适量的水,并将湿润的红色石蕊试纸放在试管口 试管中有气体产生,湿润的红色石蕊试纸变蓝,证明猜想正确 【反思与交流】O₂比N₂的化学性质活泼(合理即可)
(1)2Mg+O₂点燃2MgO
(2)不同意 镁燃烧是镁与空气中的氧气等气体的反应
(3)【实验探究】取少量黄色固体于试管中,加入适量的水,并将湿润的红色石蕊试纸放在试管口 试管中有气体产生,湿润的红色石蕊试纸变蓝,证明猜想正确 【反思与交流】O₂比N₂的化学性质活泼(合理即可)
查看更多完整答案,请扫码查看


