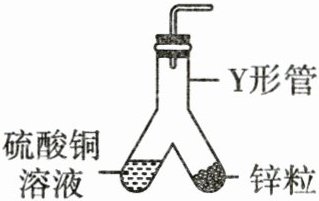
13. 用如图所示装置进行实验,倾斜Y形管,锌粒与硫酸铜溶液接触,表面有气泡产生并析出红色物质,溶液颜色变浅,经检测产生的气体为氢气。下列说法正确的是( )。
A.锌粒参加的反应均为置换反应
B.硫酸铜溶液所含阳离子只有$Cu^2⁺$
C.可推知金属活动性顺序:铜>锌
D.若用银片代替锌粒,可观察到相似的实验现象

A.锌粒参加的反应均为置换反应
B.硫酸铜溶液所含阳离子只有$Cu^2⁺$
C.可推知金属活动性顺序:铜>锌
D.若用银片代替锌粒,可观察到相似的实验现象
答案:
A [解析]锌属于活泼金属,能和酸发生置换反应生成氢气,还能和比锌金属活动性弱的金属的盐溶液发生置换反应生成新金属和新盐,所以锌粒和硫酸铜溶液接触时,发生反应生成氢气和铜,其中锌粒参加的反应均为置换反应,A正确;锌粒和硫酸铜溶液接触时,反应生成氢气和铜,说明硫酸铜溶液中含有氢离子和铜离子,B错误;因为锌粒和硫酸铜溶液接触时有红色固体产生,说明锌的金属活动性比铜强,C错误;银的金属活动性比铜弱,铜的金属活动性比氢弱,所以若用银片代替锌粒放入硫酸铜溶液中,无明显现象,D错误。
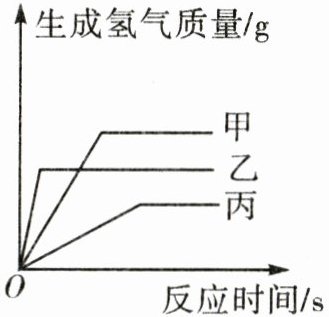
14. 现有等质量甲、乙、丙三种金属,分别放入三份完全相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中化合价均为+2),则下列说法中不正确的是( )。
A.相对原子质量:丙>乙>甲
B.金属的活动性:丙>乙>甲
C.生成氢气的质量:甲>乙>丙
D.消耗稀硫酸的质量:甲>乙>丙

A.相对原子质量:丙>乙>甲
B.金属的活动性:丙>乙>甲
C.生成氢气的质量:甲>乙>丙
D.消耗稀硫酸的质量:甲>乙>丙
答案:
B [解析]等质量的甲、乙、丙三种金属分别与足量稀硫酸反应生成正二价金属硫酸盐和氢气,由于化合价相同,产生氢气的质量与金属的相对原子质量成反比,产生氢气的质量越多,说明该金属的相对原子质量越小,则相对原子质量:丙>乙>甲,A正确;由氢气的质量与反应时间的关系图可知,等质量甲、乙、丙三种金属分别与足量稀硫酸反应至完全反应,乙用的时间少,甲其次,丙用的时间多,由金属的活动性越强,与酸反应的速率越快可知,金属活动性顺序为乙>甲>丙,B错误;由纵坐标可知,生成氢气的质量:甲>乙>丙,C正确;生成的氢气来源于稀硫酸中的氢元素,生成氢气的质量:甲>乙>丙,则消耗稀硫酸的质量:甲>乙>丙,D正确。
15. 将2.4g含镁的混合物与足量盐酸反应,生成氢气的质量为0.18g,则混入的另一种物质不可能是( )。
A.Al
B.Fe
C.Cu
D.Zn
A.Al
B.Fe
C.Cu
D.Zn
答案:
A
16. (8分) 新情境 中国汽车产业绿色低碳发展路线 《中国汽车产业绿色低碳发展路线图1.0》明确提出,中国汽车产业绿色低碳发展的总体目标是力争2030年前实现“碳达峰”,2060年前实现“碳中和”。
请你回答下列问题:
(1)能产生温室效应的气体是 (填字母)。
A. CO
$B. CO_2$
$C. H_2$
$D. NH_3$
(2)为了节省石油资源,可添加甲醇到汽油中制成甲醇汽油,在催化剂的作用下$,CO_2$与$H_2$反应生成甲醇$(CH_3OH)$和$H_2O,$写出该反应的化学方程式: 。
(3)将二氧化碳直接注入深海可以缓解全球气候变暖,因为二氧化碳可以和水反应生成 (填化学式)。
(4)二氧化碳常用于灭火的原因是 。
请你回答下列问题:
(1)能产生温室效应的气体是 (填字母)。
A. CO
$B. CO_2$
$C. H_2$
$D. NH_3$
(2)为了节省石油资源,可添加甲醇到汽油中制成甲醇汽油,在催化剂的作用下$,CO_2$与$H_2$反应生成甲醇$(CH_3OH)$和$H_2O,$写出该反应的化学方程式: 。
(3)将二氧化碳直接注入深海可以缓解全球气候变暖,因为二氧化碳可以和水反应生成 (填化学式)。
(4)二氧化碳常用于灭火的原因是 。
答案:
(1)B
(2)$CO_2+3H_2\stackrel{催化剂}{=}CH_3OH+H_2O$
(3)$H_2CO_3$
(4)密度比空气大,不燃烧,也不支持燃烧
(1)B
(2)$CO_2+3H_2\stackrel{催化剂}{=}CH_3OH+H_2O$
(3)$H_2CO_3$
(4)密度比空气大,不燃烧,也不支持燃烧
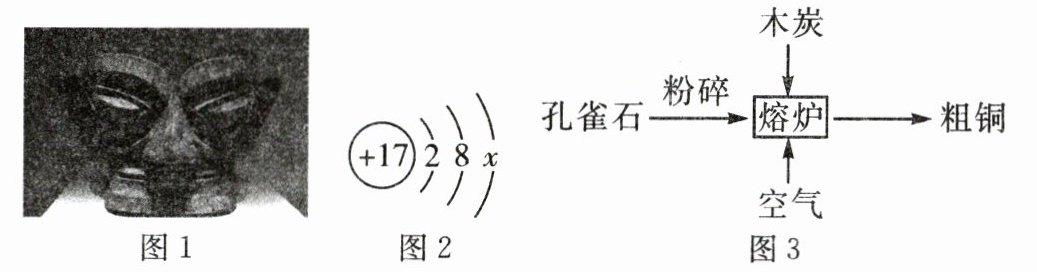
17. (6分)三星堆遗址出土的青铜制品造型奇特,制作精美,是极为罕见的人类上古史奇珍。
(1)材料:青铜是铜、锡、铅等元素形成的合金,其硬度比纯铜 ,属于 材料。
(2)变化:青铜制品初始颜色为金黄色,出土的青铜制品表面呈青绿色,主要成分为碱式碳酸铜,含少量氧化亚铜$(Cu_2O)、$氯化亚铜(CuCl)等。请标出氧化亚铜中铜元素的化合价: 。自然界中的氯离子对青铜制品有较大的破坏作用,如图2是氯离子的结构示意图,其中x= 。
(3)制备:古代常以孔雀石[主要成分$Cu_2(OH)_2CO_3]$为原料炼铜,主要流程如图3。
①该流程中将孔雀石粉碎的主要目的是 。
②熔炉中孔雀石受热分解生成三种氧化物,反应的化学方程式为 。

(1)材料:青铜是铜、锡、铅等元素形成的合金,其硬度比纯铜 ,属于 材料。
(2)变化:青铜制品初始颜色为金黄色,出土的青铜制品表面呈青绿色,主要成分为碱式碳酸铜,含少量氧化亚铜$(Cu_2O)、$氯化亚铜(CuCl)等。请标出氧化亚铜中铜元素的化合价: 。自然界中的氯离子对青铜制品有较大的破坏作用,如图2是氯离子的结构示意图,其中x= 。
(3)制备:古代常以孔雀石[主要成分$Cu_2(OH)_2CO_3]$为原料炼铜,主要流程如图3。
①该流程中将孔雀石粉碎的主要目的是 。
②熔炉中孔雀石受热分解生成三种氧化物,反应的化学方程式为 。
答案:
(1)大 金属
(2)$\stackrel{+1}{Cu_2}$O 8
(3)①增大反应物之间的接触面积,使反应快速充分,提高产率 ②$Cu_2(OH)_2CO_3\xlongequal{\triangle}2CuO+CO_2\uparrow+H_2O$ [解析]
(1)合金的硬度比其组分金属的硬度大,青铜是铜、锡、铅等元素形成的合金,其硬度比纯铜大,属于金属材料。
(2)在化合物中元素化合价代数和为零,在Cu₂O中O为-2价,则Cu的化合价为+1,依据化合价的表示方法可知,氧化亚铜中铜元素的化合价表示为$\stackrel{+1}{Cu_2}$O;分析图2可知,x=8。
(3)①该流程中将孔雀石粉碎的主要目的是增大反应物之间的接触面积,使反应快速充分,提高产率;②孔雀石受热分解生成三种氧化物,依据质量守恒定律可知,反应的化学方程式为Cu₂(OH)₂CO₃$\stackrel{\triangle}{=}$2CuO+CO₂↑+H₂O。
(1)大 金属
(2)$\stackrel{+1}{Cu_2}$O 8
(3)①增大反应物之间的接触面积,使反应快速充分,提高产率 ②$Cu_2(OH)_2CO_3\xlongequal{\triangle}2CuO+CO_2\uparrow+H_2O$ [解析]
(1)合金的硬度比其组分金属的硬度大,青铜是铜、锡、铅等元素形成的合金,其硬度比纯铜大,属于金属材料。
(2)在化合物中元素化合价代数和为零,在Cu₂O中O为-2价,则Cu的化合价为+1,依据化合价的表示方法可知,氧化亚铜中铜元素的化合价表示为$\stackrel{+1}{Cu_2}$O;分析图2可知,x=8。
(3)①该流程中将孔雀石粉碎的主要目的是增大反应物之间的接触面积,使反应快速充分,提高产率;②孔雀石受热分解生成三种氧化物,依据质量守恒定律可知,反应的化学方程式为Cu₂(OH)₂CO₃$\stackrel{\triangle}{=}$2CuO+CO₂↑+H₂O。
查看更多完整答案,请扫码查看


