1. 根据化学方程式计算的主要步骤:
①设______;
②写______;
③找______;
④建立______;
⑤求______。
①设______;
②写______;
③找______;
④建立______;
⑤求______。
答案:
①未知量 ②化学方程式 ③反应物和生成物的质量关系④含未知量的比例关系 ⑤未知量,并作答
2. 有关化学方程式的计算有以下几种基本类型:
(1)已知反应物的质量求______的质量。
(2)已知生成物的质量求______的质量。
(3)已知一种反应物的质量求另一种______的质量。
(4)已知一种生成物的质量求另一种______的质量。
(1)已知反应物的质量求______的质量。
(2)已知生成物的质量求______的质量。
(3)已知一种反应物的质量求另一种______的质量。
(4)已知一种生成物的质量求另一种______的质量。
答案:
(1)生成物
(2)反应物
(3)反应物
(4)生成物
(1)生成物
(2)反应物
(3)反应物
(4)生成物
3. 在反应$2\mathrm{C}\mathrm{O}+{\mathrm{O}}_{2}\xlongequal{点燃}2\mathrm{C}{\mathrm{O}}_{2}$中,各物质间的质量比为( )。
A.$2:1:2$
B.$56:32:88$
C.$28:32:44$
D.$1:1:2$
A.$2:1:2$
B.$56:32:88$
C.$28:32:44$
D.$1:1:2$
答案:
B 解析 一氧化碳和氧气反应的化学方程式如下:2CO+O₂点燃2CO₂56 32 88在此反应中一氧化碳、氧气和二氧化碳的质量比为56:32:88。故选B。
4. 在反应$2\mathrm{A}+7\mathrm{B}\xlongequal{\;\;}6\mathrm{C}+4\mathrm{D}$中,C、D 的相对分子质量之比为$9:22$。若$3\;\mathrm{g}\;\mathrm{A}$与 B 完全反应后,生成$8.8\;\mathrm{g}\;\mathrm{D}$,则参加反应的 B 的质量为( )。
A.$9.4\;\mathrm{g}$
B.$11.2\;\mathrm{g}$
C.$14.3\;\mathrm{g}$
D.$20.1\;\mathrm{g}$
A.$9.4\;\mathrm{g}$
B.$11.2\;\mathrm{g}$
C.$14.3\;\mathrm{g}$
D.$20.1\;\mathrm{g}$
答案:
B 解析 根据C、D的相对分子质量之比为9:22,设C、D的相对分子质量分别为9a、22a,设生成C的质量为x。2A+7B=6C+4D54a 88ax 8.8g54a/88a=x/8.8g,解得x=5.4g;由质量守恒定律可得参加反应的B的质量为5.4g+8.8g-3g=11.2g。故选B。
5. 氮化铝(AlN)被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应制得:$\mathrm{A}{\mathrm{l}}_{2}{\mathrm{O}}_{3}+{\mathrm{N}}_{2}+3\mathrm{C}\xlongequal{一定条件}2\mathrm{A}\mathrm{l}\mathrm{N}+3\mathrm{C}\mathrm{O}$。
(1)$\mathrm{A}{\mathrm{l}}_{2}{\mathrm{O}}_{3}$中铝元素的质量分数为______(写出计算式)。
(2)$\mathrm{C}\mathrm{O}$中碳原子和氧原子的个数比为______。
(3)现欲制备$24.6\;\mathrm{t}$氮化铝,计算理论上需要氮气的质量。
(1)$\mathrm{A}{\mathrm{l}}_{2}{\mathrm{O}}_{3}$中铝元素的质量分数为______(写出计算式)。
(2)$\mathrm{C}\mathrm{O}$中碳原子和氧原子的个数比为______。
(3)现欲制备$24.6\;\mathrm{t}$氮化铝,计算理论上需要氮气的质量。
答案:
(1)27×2/(27×2+16×3)×100%
(2)1:1
(3)8.4t解析
(1)Al₂O₃中铝元素的质量分数=27×2/(27×2+16×3)×100%;
(2)CO中碳原子和氧原子的个数比为1:1;
(3)设理论上需要氮气的质量为x。Al₂O₃+N₂+3C=2AIN+3CO28 82x 24.6t28/82=x/24.6t x=8.4t答:理论上需要氮气的质量为8.4t。
(1)27×2/(27×2+16×3)×100%
(2)1:1
(3)8.4t解析
(1)Al₂O₃中铝元素的质量分数=27×2/(27×2+16×3)×100%;
(2)CO中碳原子和氧原子的个数比为1:1;
(3)设理论上需要氮气的质量为x。Al₂O₃+N₂+3C=2AIN+3CO28 82x 24.6t28/82=x/24.6t x=8.4t答:理论上需要氮气的质量为8.4t。
6. 提分优练 某学习小组在实验室中用加热$\mathrm{K}\mathrm{C}\mathrm{l}{\mathrm{O}}_{3}和\mathrm{M}\mathrm{n}{\mathrm{O}}_{2}混合物的方法制取{\mathrm{O}}_{2}$,反应过程中固体质量变化如图所示,请计算:
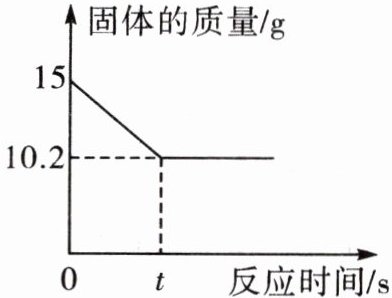
(1)制取${\mathrm{O}}_{2}$的质量是______$\mathrm{g}$。
(2)原混合物中$\mathrm{K}\mathrm{C}\mathrm{l}{\mathrm{O}}_{3}$的质量分数。(写出计算过程,计算结果精确到$0.1\%$)

(1)制取${\mathrm{O}}_{2}$的质量是______$\mathrm{g}$。
(2)原混合物中$\mathrm{K}\mathrm{C}\mathrm{l}{\mathrm{O}}_{3}$的质量分数。(写出计算过程,计算结果精确到$0.1\%$)
答案:
(1)4.8
(2)81.7%解析
(1)生成氧气的质量为15g-10.2g=4.8g;
(2)设原混合物中KClO₃的质量为x。2KClO₃MnO₂△2KCl+3O₂↑245 96x 4.8g245/96=x/4.8g x=12.25g混合物中KClO₃的质量分数=12.25g/15g×100%≈81.7%。答:原混合物中KClO₃的质量分数为81.7%。
(1)4.8
(2)81.7%解析
(1)生成氧气的质量为15g-10.2g=4.8g;
(2)设原混合物中KClO₃的质量为x。2KClO₃MnO₂△2KCl+3O₂↑245 96x 4.8g245/96=x/4.8g x=12.25g混合物中KClO₃的质量分数=12.25g/15g×100%≈81.7%。答:原混合物中KClO₃的质量分数为81.7%。
查看更多完整答案,请扫码查看


