第7页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
任务二 对燃烧热的理解和计算
[探究活动]
2023碳达峰碳中和绿色发展论坛于2023年4月7日在北京举行,主题为“贯彻新发展理念,助力碳达峰碳中和”。
当今世界多国相继规划了碳达峰、碳中和的时间节点,因此利用技术降低空气中$CO_{2}$的含量成为研究热点,大气中的$CO_{2}$主要来自煤、石油及其他含碳物质的燃烧,已知,$25\ ^{\circ }C$时,常见物质的燃烧热数据见下表:
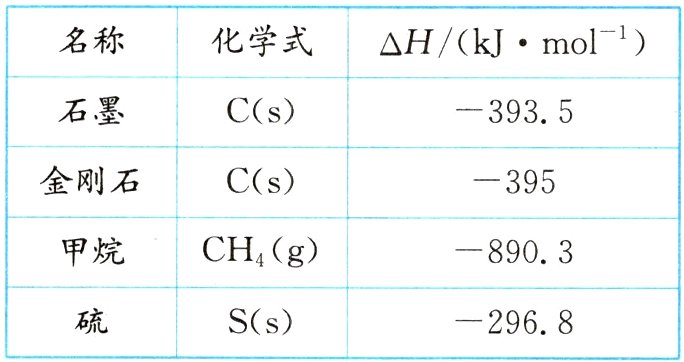
活动1 书写表示甲烷和S燃烧热的热化学方程式。
活动2 结合表中数据,思考金刚石和石墨哪者更稳定?
活动3 利用表中数据计算1kg$CH_{4}$在$25\ ^{\circ }C$,$101\ kPa$充分燃烧生成液态水时放出的热量为多少?
[探究活动]
2023碳达峰碳中和绿色发展论坛于2023年4月7日在北京举行,主题为“贯彻新发展理念,助力碳达峰碳中和”。
当今世界多国相继规划了碳达峰、碳中和的时间节点,因此利用技术降低空气中$CO_{2}$的含量成为研究热点,大气中的$CO_{2}$主要来自煤、石油及其他含碳物质的燃烧,已知,$25\ ^{\circ }C$时,常见物质的燃烧热数据见下表:

活动1 书写表示甲烷和S燃烧热的热化学方程式。
活动2 结合表中数据,思考金刚石和石墨哪者更稳定?
活动3 利用表中数据计算1kg$CH_{4}$在$25\ ^{\circ }C$,$101\ kPa$充分燃烧生成液态水时放出的热量为多少?
答案:
【探究活动】
1. 提示:CH₄(g)+2O₂(g)=CO₂(g)+2H₂O(l) ΔH=-890.3kJ·mol⁻¹;
S(s)+O₂(g)=SO₂(g) ΔH=-296.8kJ·mol⁻¹。
2. 提示:石墨较稳定,根据表中数据可知,1mol金刚石和1mol石墨分别完全燃烧时,石墨放出热量较少,说明石墨能量低,更稳定。
3. 提示:5.56×10⁴kJ。$\frac{1000g}{16g·mol⁻¹}$×890.3kJ·mol⁻¹≈5.56×10⁴kJ。
1. 提示:CH₄(g)+2O₂(g)=CO₂(g)+2H₂O(l) ΔH=-890.3kJ·mol⁻¹;
S(s)+O₂(g)=SO₂(g) ΔH=-296.8kJ·mol⁻¹。
2. 提示:石墨较稳定,根据表中数据可知,1mol金刚石和1mol石墨分别完全燃烧时,石墨放出热量较少,说明石墨能量低,更稳定。
3. 提示:5.56×10⁴kJ。$\frac{1000g}{16g·mol⁻¹}$×890.3kJ·mol⁻¹≈5.56×10⁴kJ。
[评价活动]
1. 燃烧是人们利用热能的重要方式。下列有关燃烧热的说法正确的是 ( )
A. 燃烧热所指的燃烧产物一定是相应元素的最高价氧化物
B. 含碳物质燃烧生成1mol$CO_{2}$时所放出的热量是燃烧热
C. 实验测定$H_{2}$的燃烧热时与所用$H_{2}$量的多少无关
D. 1mol C燃烧生成$CO_{2}$时放出的热量是生成CO时放出的热量的2倍
1. 燃烧是人们利用热能的重要方式。下列有关燃烧热的说法正确的是 ( )
A. 燃烧热所指的燃烧产物一定是相应元素的最高价氧化物
B. 含碳物质燃烧生成1mol$CO_{2}$时所放出的热量是燃烧热
C. 实验测定$H_{2}$的燃烧热时与所用$H_{2}$量的多少无关
D. 1mol C燃烧生成$CO_{2}$时放出的热量是生成CO时放出的热量的2倍
答案:
【评价活动】
1. C 解析:燃烧热所指的燃烧产物是指101kPa下稳定的氧化物,不一定是相应元素的最高价氧化物,如S元素的燃烧产物为SO₂,A错误;燃烧热是指1mol可燃物完全燃烧生成指定产物时所放出的热量,含碳物质可能还含有其他元素,另外含碳物质也不一定是1mol,B错误;实验测定H₂的燃烧热时最终要换算成1mol氢气燃烧生成液态水所放出的热量,与所用H₂量的多少无关,C正确;1molC燃烧生成CO₂时放出的热量与生成CO时放出的热量无法得出2倍关系,D错误。
1. C 解析:燃烧热所指的燃烧产物是指101kPa下稳定的氧化物,不一定是相应元素的最高价氧化物,如S元素的燃烧产物为SO₂,A错误;燃烧热是指1mol可燃物完全燃烧生成指定产物时所放出的热量,含碳物质可能还含有其他元素,另外含碳物质也不一定是1mol,B错误;实验测定H₂的燃烧热时最终要换算成1mol氢气燃烧生成液态水所放出的热量,与所用H₂量的多少无关,C正确;1molC燃烧生成CO₂时放出的热量与生成CO时放出的热量无法得出2倍关系,D错误。
2. 各相关物质的燃烧热$(kJ\cdot mol^{-1})$数据如下表所示。下列热化学方程式正确的是 ( )
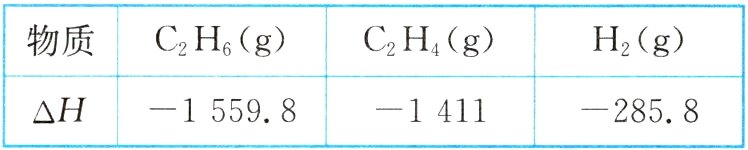
A. $C_{2}H_{4}(g)+3O_{2}(g)\xlongequal{\;\;}2CO_{2}(g)+2H_{2}O(g)$ $\Delta H=-1411\ kJ\cdot mol^{-1}$
B. $2CO_{2}(g)+3H_{2}O(g)\xlongequal{\;\;}C_{2}H_{6}(g)+\frac{7}{2}O_{2}(g)$ $\Delta H=+1559.8\ kJ\cdot mol^{-1}$
C. $2H_{2}O(l)\xlongequal{\;\;}O_{2}(g)+2H_{2}(g)$ $\Delta H=+285.8\ kJ\cdot mol^{-1}$
D. $C_{2}H_{6}(g)+\frac{7}{2}O_{2}(g)\xlongequal{\;\;}2CO_{2}(g)+3H_{2}O(l)$ $\Delta H=-1559.8\ kJ\cdot mol^{-1}$

A. $C_{2}H_{4}(g)+3O_{2}(g)\xlongequal{\;\;}2CO_{2}(g)+2H_{2}O(g)$ $\Delta H=-1411\ kJ\cdot mol^{-1}$
B. $2CO_{2}(g)+3H_{2}O(g)\xlongequal{\;\;}C_{2}H_{6}(g)+\frac{7}{2}O_{2}(g)$ $\Delta H=+1559.8\ kJ\cdot mol^{-1}$
C. $2H_{2}O(l)\xlongequal{\;\;}O_{2}(g)+2H_{2}(g)$ $\Delta H=+285.8\ kJ\cdot mol^{-1}$
D. $C_{2}H_{6}(g)+\frac{7}{2}O_{2}(g)\xlongequal{\;\;}2CO_{2}(g)+3H_{2}O(l)$ $\Delta H=-1559.8\ kJ\cdot mol^{-1}$
答案:
2. D 解析:H₂O应该为液态,A、B错误;氢气的燃烧热ΔH=-285.8kJ·mol⁻¹,则应为H₂O(l)=O₂(g)+H₂(g) ΔH=+285.8kJ·mol⁻¹,C错误。
查看更多完整答案,请扫码查看


