第68页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
3. 工业制氯化铜时,将浓盐酸用蒸气加热至80 ℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌使之溶解,反应:CuO+2HCl══CuCl₂+H₂O,FeO+2HCl══FeCl₂+H₂O。已知:pH≥9.6时,Fe²⁺以Fe(OH)₂的形式完全沉淀;pH≥6.4时,Cu²⁺以Cu(OH)₂的形式完全沉淀;pH为3~4时,Fe³⁺以Fe(OH)₃的形式完全沉淀。
(1)为除去溶液中的Fe²⁺,可采用的方法是________(填字母序号,下同)。
A. 直接加碱,调整溶液pH≥9.6
B. 加纯铜粉,将Fe²⁺还原出来
C. 先将Fe²⁺氧化成Fe³⁺,再调整pH到3~4
D. 通入硫化氢,使Fe²⁺直接沉淀
(2)工业上为除去溶液中的Fe²⁺,常使用NaClO,当溶液中加入NaClO后,溶液pH的变化情况是________。
A. 肯定减小 B. 肯定增大
C. 可能减小 D. 可能增大
(3)若此溶液中只含有Fe³⁺时,要调整pH为3~4,此时最好向溶液中加入________。
A. NaOH溶液 B. 氨水
C. CuCl₂溶液 D. CuO固体
(1)为除去溶液中的Fe²⁺,可采用的方法是________(填字母序号,下同)。
A. 直接加碱,调整溶液pH≥9.6
B. 加纯铜粉,将Fe²⁺还原出来
C. 先将Fe²⁺氧化成Fe³⁺,再调整pH到3~4
D. 通入硫化氢,使Fe²⁺直接沉淀
(2)工业上为除去溶液中的Fe²⁺,常使用NaClO,当溶液中加入NaClO后,溶液pH的变化情况是________。
A. 肯定减小 B. 肯定增大
C. 可能减小 D. 可能增大
(3)若此溶液中只含有Fe³⁺时,要调整pH为3~4,此时最好向溶液中加入________。
A. NaOH溶液 B. 氨水
C. CuCl₂溶液 D. CuO固体
答案:
3. 解析:
(1)A 项中$pH\geq9.6$时,$Cu^{2+}$也将沉淀;B 项中,铜粉不能将$Fe^{2+}$还原出来;D 项中,$Fe^{2+}$与$H_{2}S$不反应。
(2)$NaClO$具有强氧化性,能将$Fe^{2+}$氧化:$2Fe^{2+}+ClO^{-}+2H^{+}=2Fe^{3+}+Cl^{-}+H_{2}O$,反应中消耗$H^{+}$,$pH$一定增大。
(3)此溶液中只含杂质$Fe^{3+}$,要调整$pH$到$3~4$,加入的物质必须能与酸反应,使$c(H^{+})$减小,且不引入新的杂质离子,D 项符合条件。
答案:
(1)C
(2)B
(3)D
(1)A 项中$pH\geq9.6$时,$Cu^{2+}$也将沉淀;B 项中,铜粉不能将$Fe^{2+}$还原出来;D 项中,$Fe^{2+}$与$H_{2}S$不反应。
(2)$NaClO$具有强氧化性,能将$Fe^{2+}$氧化:$2Fe^{2+}+ClO^{-}+2H^{+}=2Fe^{3+}+Cl^{-}+H_{2}O$,反应中消耗$H^{+}$,$pH$一定增大。
(3)此溶液中只含杂质$Fe^{3+}$,要调整$pH$到$3~4$,加入的物质必须能与酸反应,使$c(H^{+})$减小,且不引入新的杂质离子,D 项符合条件。
答案:
(1)C
(2)B
(3)D
4. (2022·全国甲卷节选)硫酸锌(ZnSO₄)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备。菱锌矿的主要成分为ZnCO₃,杂质为SiO₂以及Ca、Mg、Fe、Cu等的化合物。其制备流程如下:
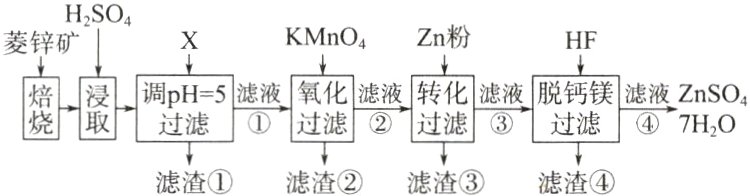
本题中所涉及离子的氢氧化物溶度积常数如下表:

加入物质X调溶液pH=5,最适宜使用的X是________。
A. NH₃·H₂O B. Ca(OH)₂ C. NaOH
滤渣①的主要成分是________、________、________。
任务总结
沉淀反应的应用
(1)沉淀的生成和溶解这两个方向相反的过程,控制离子浓度,可以使反应向我们需要的方向转化。
(2)利用生成沉淀除去某种离子,首先要使生成沉淀的反应能够发生,其次沉淀生成的反应进行得越完全越好。
(3)根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。如常用强酸溶解CaCO₃、FeS、Al(OH)₃、Cu(OH)₂等难溶电解质。

本题中所涉及离子的氢氧化物溶度积常数如下表:

加入物质X调溶液pH=5,最适宜使用的X是________。
A. NH₃·H₂O B. Ca(OH)₂ C. NaOH
滤渣①的主要成分是________、________、________。
任务总结
沉淀反应的应用
(1)沉淀的生成和溶解这两个方向相反的过程,控制离子浓度,可以使反应向我们需要的方向转化。
(2)利用生成沉淀除去某种离子,首先要使生成沉淀的反应能够发生,其次沉淀生成的反应进行得越完全越好。
(3)根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。如常用强酸溶解CaCO₃、FeS、Al(OH)₃、Cu(OH)₂等难溶电解质。
答案:
4. 解析:$NH_{3}\cdot H_{2}O$易分解产生$NH_{3}$污染空气,且经济成本较高,故 A 不适宜;加入$Ca(OH)_{2}$不会引入新的杂质,且成本较低,故 B 适宜;加入$NaOH$会引入杂质$Na^{+}$,且成本较高,C 不适宜;当沉淀完全时(离子浓度小于$10^{-5}mol\cdot L^{-1}$),结合表格$K_{sp}$计算各离子完全沉淀时$pH<5$的只有$Fe^{3+}$,故滤渣①中有$Fe(OH)_{3}$,又$CaSO_{4}$是微溶物,$SiO_{2}$不溶于酸,故滤渣①的主要成分是$Fe(OH)_{3}$、$CaSO_{4}$、$SiO_{2}$。
答案:B $Fe(OH)_{3}$ $CaSO_{4}$ $SiO_{2}$
答案:B $Fe(OH)_{3}$ $CaSO_{4}$ $SiO_{2}$
查看更多完整答案,请扫码查看


