第56页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
9. “敞锅熬盐”是我国古代制盐的方法,其流程如图所示。其中操作Ⅱ“花水”冲洗既可减少粗盐表面的杂质,又不损失NaCl的质量。下列说法不正确的是 ( )
已知:BaCl₂ + MgSO₄ == BaSO₄↓ + MgCl₂。
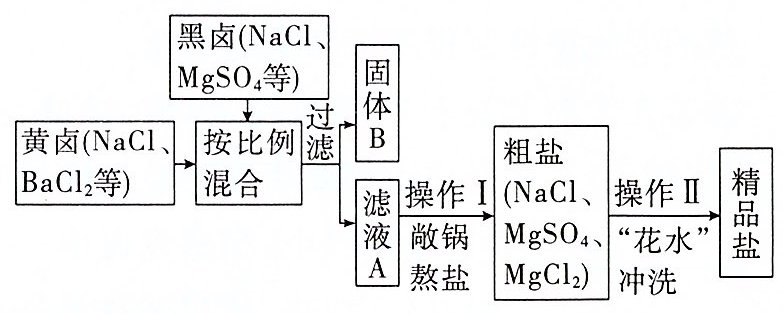
A. 固体B中含有反应生成的沉淀BaSO₄
B. 操作Ⅰ敞锅熬盐的原理是蒸发结晶
C. 将黄卤、黑卤按比例混合是为了使其恰好完全反应
D. “花水”应选用的是NaCl饱和溶液
已知:BaCl₂ + MgSO₄ == BaSO₄↓ + MgCl₂。

A. 固体B中含有反应生成的沉淀BaSO₄
B. 操作Ⅰ敞锅熬盐的原理是蒸发结晶
C. 将黄卤、黑卤按比例混合是为了使其恰好完全反应
D. “花水”应选用的是NaCl饱和溶液
答案:
C
10. 21世纪我国海洋事业的总目标是建成现代化的海洋强国。某化学兴趣小组的同学们利用寒假时间,通过参观场馆、采访专家、实验模拟等形式,就“海洋资源的综合利用与制盐”展开了项目式学习。
活动一:认识海洋资源
[参观场馆]同学们走进山西某海洋馆,认真学习了有关海洋资源的知识,参观结束时海洋馆的工作人员向同学们赠送了海水样品。
[归纳总结](1)海洋除蕴含着丰富的水资源外,还可为人类提供的资源是______________________________(写一种)。
(2)海水中的氯、钠、镁、钾、溴等11种________(填“元素”“原子”或“单质”),占海水所溶解物质总质量的99.8%以上,从中可以提取50多种化学物质。
活动二:了解海水淡化
[采访专家]同学们来到某大学,聆听有关专家介绍海水淡化的常用方法和最新研究:目前海水淡化的主流方法有多效蒸发海水淡化技术和反渗透技术,除盐率可高达96%。
[交流心得](3)将海水蒸发淡化的过程属于________变化。
(4)淡化后的海水属于软水,其中可溶性钙、镁化合物的含量________(填“增大”“减小”或“不变”)。
活动三:模拟海水晒盐
海水晒盐的目的是从海水中获取NaCl。同学们在实验室中用海水样品模拟海水晒盐。
[实验模拟]取少量海水进行过滤。将过滤后的海水倒入蒸发皿中,点燃酒精灯加热海水,同时用玻璃棒不断搅拌。一段时间后有晶体析出,停止加热。
[实验分析]同学们利用海水中两种主要物质的溶解度表(如下),对海水晒盐的过程进行分析。
|温度/℃|0|20|40|60|80|100|
|----|----|----|----|----|----|----|
|溶解度/g|NaCl|35.7|36.0|36.6|37.3|38.4|39.8|
|CaCl₂|59.5|74.5|128|137|147|159|
(5)海水晒盐过程中析出的主要物质是______,原因是______________________________;剩余海水为这种物质的______(填“饱和”或“不饱和”)溶液。
(6)实验停止后,剩余海水温度恢复至20℃,此时海水中NaCl的质量分数为________(结果精确到0.1%)。
(7)若将海水完全蒸干反而不利于制盐,原因是______________________________。
[成果分享]通过此次项目式学习,同学们认识到,要学好知识,用好知识,真正认识世界,合理开发资源,为报效祖国贡献自己的力量。
活动一:认识海洋资源
[参观场馆]同学们走进山西某海洋馆,认真学习了有关海洋资源的知识,参观结束时海洋馆的工作人员向同学们赠送了海水样品。
[归纳总结](1)海洋除蕴含着丰富的水资源外,还可为人类提供的资源是______________________________(写一种)。
(2)海水中的氯、钠、镁、钾、溴等11种________(填“元素”“原子”或“单质”),占海水所溶解物质总质量的99.8%以上,从中可以提取50多种化学物质。
活动二:了解海水淡化
[采访专家]同学们来到某大学,聆听有关专家介绍海水淡化的常用方法和最新研究:目前海水淡化的主流方法有多效蒸发海水淡化技术和反渗透技术,除盐率可高达96%。
[交流心得](3)将海水蒸发淡化的过程属于________变化。
(4)淡化后的海水属于软水,其中可溶性钙、镁化合物的含量________(填“增大”“减小”或“不变”)。
活动三:模拟海水晒盐
海水晒盐的目的是从海水中获取NaCl。同学们在实验室中用海水样品模拟海水晒盐。
[实验模拟]取少量海水进行过滤。将过滤后的海水倒入蒸发皿中,点燃酒精灯加热海水,同时用玻璃棒不断搅拌。一段时间后有晶体析出,停止加热。
[实验分析]同学们利用海水中两种主要物质的溶解度表(如下),对海水晒盐的过程进行分析。
|温度/℃|0|20|40|60|80|100|
|----|----|----|----|----|----|----|
|溶解度/g|NaCl|35.7|36.0|36.6|37.3|38.4|39.8|
|CaCl₂|59.5|74.5|128|137|147|159|
(5)海水晒盐过程中析出的主要物质是______,原因是______________________________;剩余海水为这种物质的______(填“饱和”或“不饱和”)溶液。
(6)实验停止后,剩余海水温度恢复至20℃,此时海水中NaCl的质量分数为________(结果精确到0.1%)。
(7)若将海水完全蒸干反而不利于制盐,原因是______________________________。
[成果分享]通过此次项目式学习,同学们认识到,要学好知识,用好知识,真正认识世界,合理开发资源,为报效祖国贡献自己的力量。
答案:
(1)化学资源(或矿产资源、动力资源、生物资源等) (2)元素
(3)物理 (4)减小 (5)$NaCl$ 氯化钠的溶解度受温度影响变化不大,蒸发过程中结晶析出;氯化钙的溶解度随温度升高而增大,且受温度影响变化较大,故蒸发过程中,氯化钙溶解在水中达不到饱和状态,不易析出 饱和 (6)26.5% (7)若将海水完全蒸干,氯化钙等杂质会留在所得氯化钠固体中,导致得到的氯化钠不纯,增加了除杂的难度和成本
查看更多完整答案,请扫码查看


