第57页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
- 第205页
- 第206页
- 第207页
- 第208页
- 第209页
- 第210页
- 第211页
- 第212页
- 第213页
- 第214页
- 第215页
- 第216页
- 第217页
- 第218页
- 第219页
- 第220页
- 第221页
- 第222页
- 第223页
- 第224页
- 第225页
- 第226页
- 第227页
- 第228页
- 第229页
- 第230页
- 第231页
- 第232页
- 第233页
- 第234页
- 第235页
- 第236页
- 第237页
- 第238页
- 第239页
- 第240页
- 第241页
- 第242页
- 第243页
- 第244页
- 第245页
- 第246页
- 第247页
- 第248页
- 第249页
- 第250页
- 第251页
- 第252页
- 第253页
- 第254页
- 第255页
- 第256页
- 第257页
- 第258页
- 第259页
- 第260页
- 第261页
- 第262页
- 第263页
整合 必备知识
氢氧化铁和氢氧化亚铁的比较
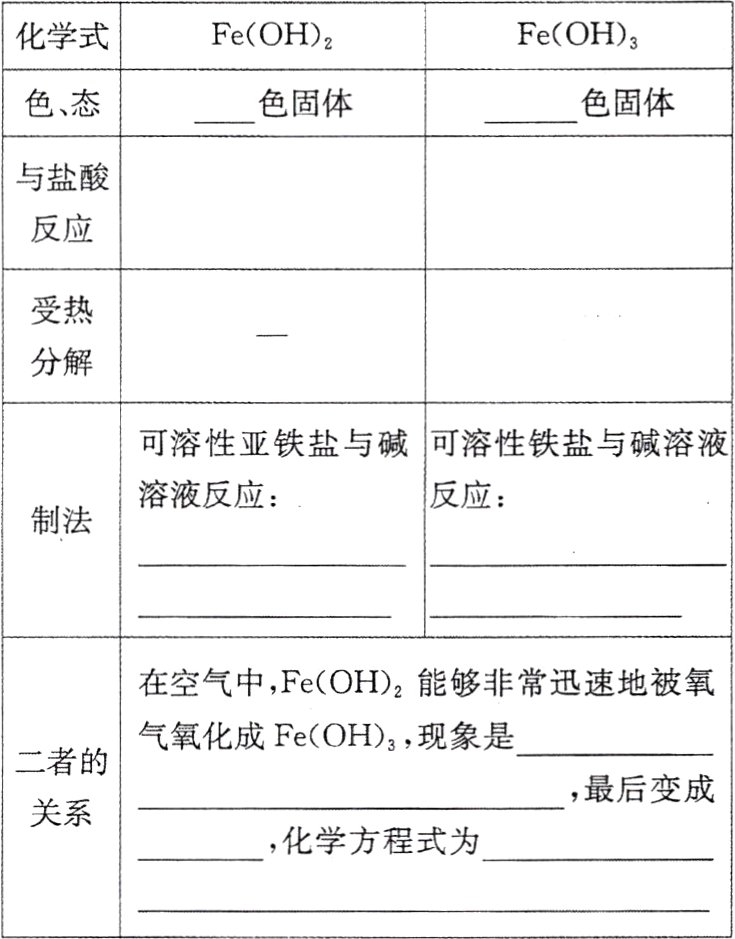
氢氧化铁和氢氧化亚铁的比较

答案:
白 红褐 $Fe(OH)_2 + 2H^+ = Fe^{2+} + 2H_2O$ $Fe(OH)_3 + 3H^+ = Fe^{3+} + 3H_2O$ $2Fe(OH)_3 \stackrel{\triangle}{=\!=\!=} Fe_2O_3 + 3H_2O$ $Fe^{2+} + 2OH^- = Fe(OH)_2\downarrow$ $Fe^{3+} + 3OH^- = Fe(OH)_3\downarrow$ 白色絮状沉淀迅速变成灰绿色 红褐色 $4Fe(OH)_2 + O_2 + 2H_2O = 4Fe(OH)_3$
易错辨析
1. Fe(OH)₃在空气中加热分解生成Fe₂O₃,则Fe(OH)₂在空气中加热分解生成FeO( )
2. 将热的NaOH溶液滴入FeCl₃溶液中可制备Fe(OH)₃胶体( )
3. FeCl₃、FeCl₂和Fe(OH)₃都可以通过化合反应制取( )
4. 氢氧化铁与HI溶液仅发生中和反应( )
5. 向氢氧化亚铁中加入足量的稀硝酸,反应的离子方程式是Fe(OH)₂ + 2H⁺ = Fe²⁺ + 2H₂O( )
1. Fe(OH)₃在空气中加热分解生成Fe₂O₃,则Fe(OH)₂在空气中加热分解生成FeO( )
2. 将热的NaOH溶液滴入FeCl₃溶液中可制备Fe(OH)₃胶体( )
3. FeCl₃、FeCl₂和Fe(OH)₃都可以通过化合反应制取( )
4. 氢氧化铁与HI溶液仅发生中和反应( )
5. 向氢氧化亚铁中加入足量的稀硝酸,反应的离子方程式是Fe(OH)₂ + 2H⁺ = Fe²⁺ + 2H₂O( )
答案:
×
@@×
@@√
@@×
@@×
@@×
@@√
@@×
@@×
一、Fe(OH)₂的制备操作与条件控制
1. 氢氧化亚铁可以用来制颜料、药物、催化剂、吸收剂和砷解毒剂等。某化学兴趣小组同学设计以下实验探究氢氧化亚铁的制备。
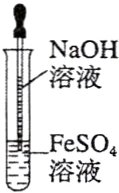
【A组实验】用FeSO₄溶液与不含O₂的蒸馏水配制的NaOH溶液反应制备Fe(OH)₂。
(1)用硫酸亚铁晶体配制上述FeSO₄溶液时还需要加入____________________。
(2)除去蒸馏水中溶解的O₂常采用________的方法。
(3)生成Fe(OH)₂白色沉淀的操作是用长滴管吸取不含O₂的NaOH溶液,插入FeSO₄溶液液面下,再挤出NaOH溶液,这样操作的理由是______________________________;为了使沉淀能持续一段时间不变色,还可在FeSO₄溶液上面加保护层,如______等。
【B组实验】选用稀硫酸、铁粉、NaOH溶液进行实验,装置如图。
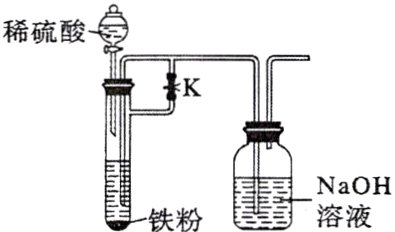
(4)实验时,先________(填“打开”或“关闭”,下同)止水夹K,然后打开分液漏斗的玻璃塞和活塞,使稀硫酸与铁粉反应,一段时间后,________止水夹K,利用氢气造成试管内的压强增大,将FeSO₄溶液压至NaOH溶液中反应制得白色Fe(OH)₂沉淀,且沉淀能持续一段时间不变色。沉淀能一段时间不变色的原因是________。
【C组实验】利用电解实验可以制得纯净的Fe(OH)₂白色沉淀,如图所示,已知两电极的材料分别为石墨和铁。
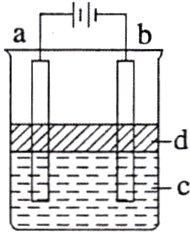
(5)①a电极的材料应为______,电极反应式为______________________________。
②电解液c可以是________(填字母)。
A. 纯水 B. NaCl溶液
C. NaOH溶液 D. CuCl₂溶液
③d为苯,其作用是________________________,在加入苯之前对电解液c应作何简单处理?______________________________。能否将苯替换成CCl₄?________(填“能”或“否”),理由是______________________________。
(6)若c为Na₂SO₄溶液,当电解一段时间后看到白色Fe(OH)₂沉淀,再反接电源电解,除了电极上看到气泡外,另一明显现象为__________。
1. 氢氧化亚铁可以用来制颜料、药物、催化剂、吸收剂和砷解毒剂等。某化学兴趣小组同学设计以下实验探究氢氧化亚铁的制备。
【A组实验】用FeSO₄溶液与不含O₂的蒸馏水配制的NaOH溶液反应制备Fe(OH)₂。
(1)用硫酸亚铁晶体配制上述FeSO₄溶液时还需要加入____________________。
(2)除去蒸馏水中溶解的O₂常采用________的方法。
(3)生成Fe(OH)₂白色沉淀的操作是用长滴管吸取不含O₂的NaOH溶液,插入FeSO₄溶液液面下,再挤出NaOH溶液,这样操作的理由是______________________________;为了使沉淀能持续一段时间不变色,还可在FeSO₄溶液上面加保护层,如______等。

【B组实验】选用稀硫酸、铁粉、NaOH溶液进行实验,装置如图。

(4)实验时,先________(填“打开”或“关闭”,下同)止水夹K,然后打开分液漏斗的玻璃塞和活塞,使稀硫酸与铁粉反应,一段时间后,________止水夹K,利用氢气造成试管内的压强增大,将FeSO₄溶液压至NaOH溶液中反应制得白色Fe(OH)₂沉淀,且沉淀能持续一段时间不变色。沉淀能一段时间不变色的原因是________。
【C组实验】利用电解实验可以制得纯净的Fe(OH)₂白色沉淀,如图所示,已知两电极的材料分别为石墨和铁。

(5)①a电极的材料应为______,电极反应式为______________________________。
②电解液c可以是________(填字母)。
A. 纯水 B. NaCl溶液
C. NaOH溶液 D. CuCl₂溶液
③d为苯,其作用是________________________,在加入苯之前对电解液c应作何简单处理?______________________________。能否将苯替换成CCl₄?________(填“能”或“否”),理由是______________________________。
(6)若c为Na₂SO₄溶液,当电解一段时间后看到白色Fe(OH)₂沉淀,再反接电源电解,除了电极上看到气泡外,另一明显现象为__________。
答案:
(1)稀$H_2SO_4$、铁屑
(2)煮沸
(3)避免生成的$Fe(OH)_2$沉淀接触$O_2$而被氧化 苯(或煤油)
(4)打开 关闭 稀硫酸与铁粉反应产生的$H_2$排出了装置中的空气
(5)①$Fe$ $Fe - 2e^- = Fe^{2+}$ ②BC ③隔绝空气,防止生成的$Fe(OH)_2$被氧化 加热煮沸,排出溶解的$O_2$ 否 $CCl_4$比$FeSO_4$溶液的密度大,在下层,无法隔绝空气
(6)白色沉淀迅速变为灰绿色,最后变成红褐色
(1)稀$H_2SO_4$、铁屑
(2)煮沸
(3)避免生成的$Fe(OH)_2$沉淀接触$O_2$而被氧化 苯(或煤油)
(4)打开 关闭 稀硫酸与铁粉反应产生的$H_2$排出了装置中的空气
(5)①$Fe$ $Fe - 2e^- = Fe^{2+}$ ②BC ③隔绝空气,防止生成的$Fe(OH)_2$被氧化 加热煮沸,排出溶解的$O_2$ 否 $CCl_4$比$FeSO_4$溶液的密度大,在下层,无法隔绝空气
(6)白色沉淀迅速变为灰绿色,最后变成红褐色
查看更多完整答案,请扫码查看


