第85页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
9. 有 $ a $ g 溶质质量分数为 10%的硝酸钾溶液,若将其溶质质量分数变为 20%,则可以采用的方法是( )
A.蒸发掉溶剂的 $ \frac{1}{2} $
B.加入 $ \frac{3}{20}a $ g 硝酸钾
C.蒸发掉 $ \frac{1}{2}a $ g 溶剂
D.加入 $ \frac{5}{14}a $ g 硝酸钾
A.蒸发掉溶剂的 $ \frac{1}{2} $
B.加入 $ \frac{3}{20}a $ g 硝酸钾
C.蒸发掉 $ \frac{1}{2}a $ g 溶剂
D.加入 $ \frac{5}{14}a $ g 硝酸钾
答案:
C
10. 向质量分数为 25%的氢氧化钠溶液中加入 10 g 氢氧化钠和 90 g 水(完全溶解),所得溶液中溶质质量分数可能为( )
A.10%
B.20%
C.25%
D.无法计算
A.10%
B.20%
C.25%
D.无法计算
答案:
B
11. (2023·眉山)将一块已生锈的铁片放入质量分数为 7.3%的稀盐酸中充分反应,测得生成 $ H_2 $ 的质量与稀盐酸的质量关系如图所示(假设铁片除有 $ Fe_2O_3 $ 外不含其他杂质)。下列说法错误的是( )
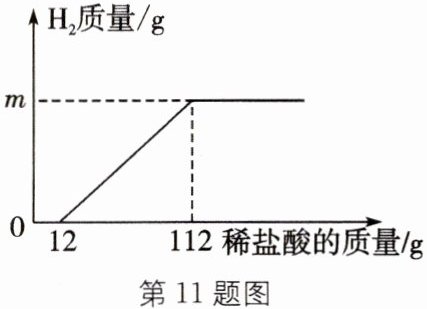
A.配制 200 g 质量分数为 7.3%的稀盐酸需要质量分数为 36.5%的浓盐酸 40 g
B.刚开始加稀盐酸时发生反应的化学方程式为 $ Fe_2O_3 + 6HCl = 2FeCl_3 + 3H_2O $
C.加入 12 g 稀盐酸时,溶液中的溶质为 $ FeCl_2 $ 和 $ FeCl_3 $
D.$ m = 0.2 $

A.配制 200 g 质量分数为 7.3%的稀盐酸需要质量分数为 36.5%的浓盐酸 40 g
B.刚开始加稀盐酸时发生反应的化学方程式为 $ Fe_2O_3 + 6HCl = 2FeCl_3 + 3H_2O $
C.加入 12 g 稀盐酸时,溶液中的溶质为 $ FeCl_2 $ 和 $ FeCl_3 $
D.$ m = 0.2 $
答案:
C
12. $ MgO $ 和 $ Mg(OH)_2 $ 固体混合粉末 24 g,其中镁元素的质量分数为 50%,放入一定量的稀硫酸中,稀硫酸恰好与两种固体完全反应,反应后形成溶液的溶质质量分数为 20%,则加入稀硫酸的溶质质量分数约为( )
A.21.16%
B.12.27%
C.17.75%
D.10.18%
A.21.16%
B.12.27%
C.17.75%
D.10.18%
答案:
C
13. 将 80 g $ M $ 物质加入 50 g 水中,充分溶解,测得溶液的质量随温度的变化曲线如图所示,按要求填空。
(1)$ A $ 点时,该溶液的溶质质量分数为______。
(2)向 $ B $ 点对应的溶液中加入 70 g 的水,所得溶液的溶质质量分数是______。
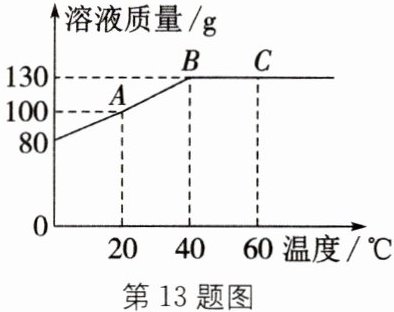
(1)$ A $ 点时,该溶液的溶质质量分数为______。
(2)向 $ B $ 点对应的溶液中加入 70 g 的水,所得溶液的溶质质量分数是______。

答案:
50%
40%
40%
14. 现有 10%的硝酸钾溶液 160 g,分为相等的两份。欲使其中一份溶质的质量分数增大一倍,计算:
(1)若用增加溶质的方法,则需增加多少克硝酸钾?
(2)若用蒸发溶剂的方法,则需蒸发掉多少克水?
(1)若用增加溶质的方法,则需增加多少克硝酸钾?
(2)若用蒸发溶剂的方法,则需蒸发掉多少克水?
答案:
解:将10\%的硝酸钾溶液$160\mathrm {g}$分为相等的两份,每一份的质量为$80\mathrm {g}。$
$(1\mathrm {)}$设需要加入硝酸钾的质量为x,则:
$\frac {80\mathrm {g}×10\%+x}{80\mathrm {g}+x}×100\%=20\%,$解得$x=10\mathrm {g}$
$(2\mathrm {)}$设需要蒸发水的质量为y,则:
$\frac {80\mathrm {g}×10\%}{80\mathrm {g}-y}×100\%=20\%,$解得$y=40\mathrm {g}$
答:$(1\mathrm {)}$若用增加溶质的方法,需增加10克硝酸钾;
$(2\mathrm {)}$若用蒸发溶剂的方法,需蒸发掉40克水。
$(1\mathrm {)}$设需要加入硝酸钾的质量为x,则:
$\frac {80\mathrm {g}×10\%+x}{80\mathrm {g}+x}×100\%=20\%,$解得$x=10\mathrm {g}$
$(2\mathrm {)}$设需要蒸发水的质量为y,则:
$\frac {80\mathrm {g}×10\%}{80\mathrm {g}-y}×100\%=20\%,$解得$y=40\mathrm {g}$
答:$(1\mathrm {)}$若用增加溶质的方法,需增加10克硝酸钾;
$(2\mathrm {)}$若用蒸发溶剂的方法,需蒸发掉40克水。
查看更多完整答案,请扫码查看


