第60页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
4. 钙是维持人体正常功能所必需的元素。如图所示为某种补钙剂“钙尔奇”说明书的一部分。取${1}$片钙尔奇,放入盛有适量稀盐酸的烧杯中,其中的碳酸钙跟盐酸完全反应(其他成分与盐酸不反应)。反应前后的质量如下,请计算:

(1) 每片钙尔奇中含碳酸钙的质量。
(2) 服用这种补钙剂,每人每天摄入钙元素的质量。
| | | |
| 反应前 | 烧杯$+$$1片钙尔奇+$稀盐酸 | ${32.00 g}$ |
| 反应后 | 烧杯$+$烧杯内的物质 | ${31.34 g}$ |
| 钙尔奇 Caltrate | |
| 主要成分:${CaCO_{3}}$ | |
| 规格:每片${2.0 g}$ | |
| 用量:每天两片 | |
| 用法:咀嚼后咽下 | |


(1) 每片钙尔奇中含碳酸钙的质量。
(2) 服用这种补钙剂,每人每天摄入钙元素的质量。
| | | |
| 反应前 | 烧杯$+$$1片钙尔奇+$稀盐酸 | ${32.00 g}$ |
| 反应后 | 烧杯$+$烧杯内的物质 | ${31.34 g}$ |
| 钙尔奇 Caltrate | |
| 主要成分:${CaCO_{3}}$ | |
| 规格:每片${2.0 g}$ | |
| 用量:每天两片 | |
| 用法:咀嚼后咽下 | |

答案:
解:$(1\mathrm {)}$设每片钙尔奇中$\mathrm {CaCO}_{3}$的质量为x。
完全反应后产生的二氧化碳的质量为$32.00\mathrm {g}-31.34\mathrm {g}=0.66\mathrm {g}$
$\mathrm{CaCO}_3+2\mathrm{HCl}\xlongequal[ ]{ }\mathrm{CaCl}_2+\mathrm{H}_2\mathrm{O}+\mathrm{CO}_2↑$
100 44
x 0.66g
$\mathrm{\frac {100 }{x }=\frac {44 }{0.66g },解得x= 1.5g }$
(2)碳酸钙中钙元素的质量分数为$\mathrm{\frac {40 }{40+12+16×3 }×100%=40 %}$
每天摄入的钙尔奇中钙元素的质量为$1.5\mathrm {g}×2×40%=1.2\mathrm {g}$
答:$(1\mathrm {)}$每片钙尔奇含有$1.5\mathrm {g}$的碳酸钙;$(2\mathrm {)}$每人每天摄入钙元素$1.2\mathrm {g}。$
完全反应后产生的二氧化碳的质量为$32.00\mathrm {g}-31.34\mathrm {g}=0.66\mathrm {g}$
$\mathrm{CaCO}_3+2\mathrm{HCl}\xlongequal[ ]{ }\mathrm{CaCl}_2+\mathrm{H}_2\mathrm{O}+\mathrm{CO}_2↑$
100 44
x 0.66g
$\mathrm{\frac {100 }{x }=\frac {44 }{0.66g },解得x= 1.5g }$
(2)碳酸钙中钙元素的质量分数为$\mathrm{\frac {40 }{40+12+16×3 }×100%=40 %}$
每天摄入的钙尔奇中钙元素的质量为$1.5\mathrm {g}×2×40%=1.2\mathrm {g}$
答:$(1\mathrm {)}$每片钙尔奇含有$1.5\mathrm {g}$的碳酸钙;$(2\mathrm {)}$每人每天摄入钙元素$1.2\mathrm {g}。$
5. 为探究${CuO}和{C}$反应的最佳质量之比(忽略副反应),化学兴趣小组取${CuO}和{C}的混合物{17.2 g}$,按不同的质量比进行实验,实验结果如图所示,横坐标表示混合物中${CuO}$所占的质量分数,纵坐标表示生成物中${Cu}$的质量。(已知${2CuO + C\xlongequal{高温}2Cu + CO_{2}↑}$)
(1) 分析可知,${CuO}和{C}$的最佳质量比对应图中的______点。
(2) 计算$a$点时,产生${CO_{2}}$的质量(写出计算过程)。
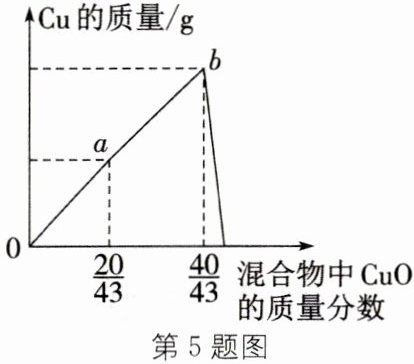
(1) 分析可知,${CuO}和{C}$的最佳质量比对应图中的______点。
(2) 计算$a$点时,产生${CO_{2}}$的质量(写出计算过程)。

答案:
b
解:由图象可知,$\mathrm {a}$点时$\mathrm {CuO}$和$\mathrm {C}$的混合物$17.2\mathrm {g}$中氧化铜的质量为:
$17.2\mathrm {g}×\frac {20}{43}=8\mathrm {g},$碳的质量是$9.2\mathrm {g}。$
由方程式质量关系可知,碳没有完全与氧化铜反应.
设生成的二氧化碳的质量为x。
$\mathrm{C+2CuO}\xlongequal[ ]{高温}2\mathrm{Cu+CO}_2↑$
160 44
8g x
$\mathrm{\frac {160 }{8g }=\frac {44 }{x },解得x=2.2g }$
答:$\mathrm {a}$点时,产生二氧化碳的质量为$2.2\mathrm {g}。$
解:由图象可知,$\mathrm {a}$点时$\mathrm {CuO}$和$\mathrm {C}$的混合物$17.2\mathrm {g}$中氧化铜的质量为:
$17.2\mathrm {g}×\frac {20}{43}=8\mathrm {g},$碳的质量是$9.2\mathrm {g}。$
由方程式质量关系可知,碳没有完全与氧化铜反应.
设生成的二氧化碳的质量为x。
$\mathrm{C+2CuO}\xlongequal[ ]{高温}2\mathrm{Cu+CO}_2↑$
160 44
8g x
$\mathrm{\frac {160 }{8g }=\frac {44 }{x },解得x=2.2g }$
答:$\mathrm {a}$点时,产生二氧化碳的质量为$2.2\mathrm {g}。$
6. 在密闭容器中${3 g}碳和{7 g}$氧气充分反应后,容器内的气体有( )
A.一氧化碳
B.二氧化碳
C.一氧化碳和二氧化碳
D.二氧化碳和氧气
A.一氧化碳
B.二氧化碳
C.一氧化碳和二氧化碳
D.二氧化碳和氧气
答案:
C
7. 向盛有足量稀盐酸的烧杯中加入${4 g}含钙元素{50\%}$(质量分数)的碳酸钙与氧化钙的固体混合物,使之完全反应。烧杯中最终增加的质量是( )
A.${0.8 g}$
B.${2 g}$
C.${1.2 g}$
D.${2.8 g}$
A.${0.8 g}$
B.${2 g}$
C.${1.2 g}$
D.${2.8 g}$
答案:
D
8. 已知:${2Na_{2}O_{2} + 2CO_{2} = 2Na_{2}CO_{3} + O_{2}}$。在真空密闭容器中,将${8.8 g CO_{2}}与一定质量的{Na_{2}O_{2}}$固体充分反应后,收集到气体${M}为x\ {g}$。下列说法正确的是( )
A.若$x = 3.2$,气体${M}中含有{CO_{2}}$
B.若$x = 6$,${Na_{2}O_{2}}$反应后可能有剩余
C.若$x = 3.2$,生成的${Na_{2}CO_{3}}的质量为{10.6 g}$
D.若$x = 6$,气体${M}中{CO_{2}}与{O_{2}}的质量之比为{11:4}$
A.若$x = 3.2$,气体${M}中含有{CO_{2}}$
B.若$x = 6$,${Na_{2}O_{2}}$反应后可能有剩余
C.若$x = 3.2$,生成的${Na_{2}CO_{3}}的质量为{10.6 g}$
D.若$x = 6$,气体${M}中{CO_{2}}与{O_{2}}的质量之比为{11:4}$
答案:
D
查看更多完整答案,请扫码查看


