第58页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
6. 为测定某种贝壳中碳酸钙的含量,取$25\ {g}$贝壳,逐渐加入稀盐酸,充分反应后,测得剩余固体质量与加入稀盐酸的质量关系如图所示(已知杂质不参与反应,也不溶于水)。请计算:
(1)这种贝壳中碳酸钙的质量分数是______。
(2)$25\ {g}$贝壳与稀盐酸恰好完全反应时,生成二氧化碳的质量为多少?(写出计算步骤)
(3)本实验是否可以用稀硫酸代替稀盐酸完成实验?请说明理由。
]

(1)这种贝壳中碳酸钙的质量分数是______。
(2)$25\ {g}$贝壳与稀盐酸恰好完全反应时,生成二氧化碳的质量为多少?(写出计算步骤)
(3)本实验是否可以用稀硫酸代替稀盐酸完成实验?请说明理由。
]

答案:
80%
解:$(2\mathrm {)}$反应生成二氧化碳的质量为x。
$\mathrm{CaCO}_3+2\mathrm{HCl}\xlongequal[ ]{ }\mathrm{CaCl}_2+\mathrm{H}_2\mathrm{O}+\mathrm{CO}_2↑$
100 44
25g-5g x
$\mathrm{\frac {100 }{20g }=\frac {44 }{x },解得x=8.8g }$
答:生成二氧化碳的质量为$8.8\mathrm {g}。$
$(3\mathrm {)}$不能,因为碳酸钙和稀硫酸反应生成微溶的硫酸钙,硫酸钙覆盖在
碳酸钙的表面阻碍碳酸钙与稀硫酸的接触,导致不能继续反应。
解:$(2\mathrm {)}$反应生成二氧化碳的质量为x。
$\mathrm{CaCO}_3+2\mathrm{HCl}\xlongequal[ ]{ }\mathrm{CaCl}_2+\mathrm{H}_2\mathrm{O}+\mathrm{CO}_2↑$
100 44
25g-5g x
$\mathrm{\frac {100 }{20g }=\frac {44 }{x },解得x=8.8g }$
答:生成二氧化碳的质量为$8.8\mathrm {g}。$
$(3\mathrm {)}$不能,因为碳酸钙和稀硫酸反应生成微溶的硫酸钙,硫酸钙覆盖在
碳酸钙的表面阻碍碳酸钙与稀硫酸的接触,导致不能继续反应。
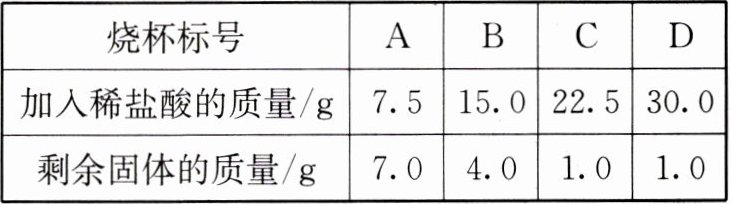
7. 某水泥厂的技术人员为测定一批石灰石矿样中碳酸钙的含量,称取四份质量均为$10.0\ {g}$的样品,磨成粉末后分别置于${A}$、${B}$、${C}$、${D}$四个烧杯中。往四个烧杯中加入不同质量的同种稀盐酸,充分反应后测量烧杯中剩余固体的质量,结果如表(样品中的杂质不溶于水且不与稀酸盐反应)。
(1)样品中碳酸钙的质量分数为______。
(2)求$10.0\ {g}$该样品与足量稀盐酸反应后产生二氧化碳的质量。
|烧杯标号|${A}$|${B}$|${C}$|${D}$|
|加入稀盐酸的质量${/g}$|$7.5$|$15.0$|$22.5$|$30.0$|
|剩余固体的质量${/g}$|$7.0$|$4.0$|$1.0$|$1.0$|
(1)样品中碳酸钙的质量分数为______。
(2)求$10.0\ {g}$该样品与足量稀盐酸反应后产生二氧化碳的质量。
|烧杯标号|${A}$|${B}$|${C}$|${D}$|
|加入稀盐酸的质量${/g}$|$7.5$|$15.0$|$22.5$|$30.0$|
|剩余固体的质量${/g}$|$7.0$|$4.0$|$1.0$|$1.0$|

答案:
90%
解:设生成二氧化碳的质量为x。
$\mathrm{CaCO}_3+2\mathrm{HCl}\xlongequal[ ]{ }\mathrm{CaCl}_2+\mathrm{H}_2\mathrm{O}+\mathrm{CO}_2↑$
100 44
10g×90% x
$\mathrm{\frac {100 }{10g×90% }=\frac {44 }{x },解得x=3.96g }$
答:$10.0\mathrm {g}$该样品与足量的稀盐酸反应后产生二氧化碳的质量为$3.96\mathrm {g}。$
解:设生成二氧化碳的质量为x。
$\mathrm{CaCO}_3+2\mathrm{HCl}\xlongequal[ ]{ }\mathrm{CaCl}_2+\mathrm{H}_2\mathrm{O}+\mathrm{CO}_2↑$
100 44
10g×90% x
$\mathrm{\frac {100 }{10g×90% }=\frac {44 }{x },解得x=3.96g }$
答:$10.0\mathrm {g}$该样品与足量的稀盐酸反应后产生二氧化碳的质量为$3.96\mathrm {g}。$
8. 将$a\ {g}$铁和碳的混合物在氧气中充分灼烧、冷却、称量,发现剩余固体的质量仍为$a\ {g}$,该混合物中碳的质量分数为( )
A.$30.0\%$
B.$22.2\%$
C.$27.6\%$
D.$10.3\%$
A.$30.0\%$
B.$22.2\%$
C.$27.6\%$
D.$10.3\%$
答案:
C
9. 实验室利用某过氧化氢溶液制取氧气,向$100\ {g}过氧化氢溶液中加入5\ {g}$二氧化锰,充分反应后,过滤,得到滤液$97.2\ {g}$,则原过氧化氢溶液中氢元素的质量分数是( )
A.$10.8\%$
B.$35\%$
C.$0.35\%$
D.$5.9\%$
A.$10.8\%$
B.$35\%$
C.$0.35\%$
D.$5.9\%$
答案:
A
10. ${FeC_{2}O_{4}}$固体受热分解产生铁的氧化物和气体。将$14.4\ {g}\ {FeC_{2}O_{4}}$隔绝空气充分加热,冷却,称得残余固体为$7.2\ {g}$。下列说法错误的是( )
A.残余固体含铁元素$5.6\ {g}$
B.残余固体为${Fe_{2}O_{3}}$
C.${FeC_{2}O_{4}}$固体分解产生的气体是混合物
D.${FeC_{2}O_{4}}$固体分解产生的气体能使澄清石灰水变浑浊
A.残余固体含铁元素$5.6\ {g}$
B.残余固体为${Fe_{2}O_{3}}$
C.${FeC_{2}O_{4}}$固体分解产生的气体是混合物
D.${FeC_{2}O_{4}}$固体分解产生的气体能使澄清石灰水变浑浊
答案:
B
查看更多完整答案,请扫码查看


