2025年与名师对话高中新教材同步导练案化学C选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年与名师对话高中新教材同步导练案化学C选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第1页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. 放热反应和吸热反应
(1)放热反应:燃料的______、酸与碱的______反应等会放出热量。
(2)吸热反应:煅烧______的反应等会吸收热量。
(1)放热反应:燃料的______、酸与碱的______反应等会放出热量。
(2)吸热反应:煅烧______的反应等会吸收热量。
答案:
(1)燃烧 中和
(2)石灰石
(1)燃烧 中和
(2)石灰石
2. 体系与环境
以研究盐酸与NaOH溶液的反应为例,我们将试管中的盐酸、NaOH溶液及发生的反应等看作一个反应______(又称______),盛溶液的试管和溶液之外的空气等看作______。
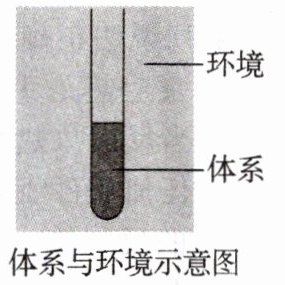
以研究盐酸与NaOH溶液的反应为例,我们将试管中的盐酸、NaOH溶液及发生的反应等看作一个反应______(又称______),盛溶液的试管和溶液之外的空气等看作______。

答案:
体系 系统 环境
3. 反应热
因温度不同而在体系与环境之间交换或传递的能量是______。在等温条件下,化学反应体系向环境______或从环境______的热量,称为化学反应的热效应,简称______。
因温度不同而在体系与环境之间交换或传递的能量是______。在等温条件下,化学反应体系向环境______或从环境______的热量,称为化学反应的热效应,简称______。
答案:
热量 释放 吸收 反应热
4. 中和反应反应热的测定
(1)实验目的:测定______与______反应的反应热。
(2)实验装置
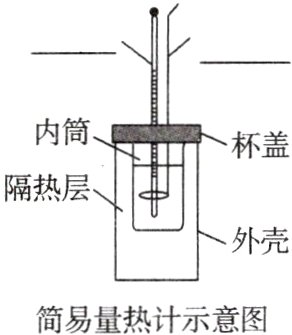
(3)实验测量
①反应物温度的测量
a. 用______量取50 mL 0.50 mol/L盐酸,打开杯盖,倒入量热计的______中,盖上杯盖,插入______,测量并记录______的温度。用水把温度计上的______冲洗干净,擦干备用。
b. 用另一个______量取50 mL 0.55 mol/L NaOH溶液,用______测量并记录______的温度。
②反应后体系温度的测定
打开杯盖,将量筒中的NaOH溶液______倒入量热计的______中,______盖上杯盖,插入______,用搅拌器______搅拌。密切关注温度变化,将______温度记为反应后体系的温度(t₂)。
③重复上述步骤①和②______次。
(4)实验数据处理
①取盐酸温度和NaOH溶液温度的______值记为反应前体系的温度(t₁)。
②取三次测量所得温度差的______值作为计算依据。计算温度差(t₂ - t₁)。
③生成1 mol水时放出的热量为______kJ。
(1)实验目的:测定______与______反应的反应热。
(2)实验装置

(3)实验测量
①反应物温度的测量
a. 用______量取50 mL 0.50 mol/L盐酸,打开杯盖,倒入量热计的______中,盖上杯盖,插入______,测量并记录______的温度。用水把温度计上的______冲洗干净,擦干备用。
b. 用另一个______量取50 mL 0.55 mol/L NaOH溶液,用______测量并记录______的温度。
②反应后体系温度的测定
打开杯盖,将量筒中的NaOH溶液______倒入量热计的______中,______盖上杯盖,插入______,用搅拌器______搅拌。密切关注温度变化,将______温度记为反应后体系的温度(t₂)。
③重复上述步骤①和②______次。
(4)实验数据处理
①取盐酸温度和NaOH溶液温度的______值记为反应前体系的温度(t₁)。
②取三次测量所得温度差的______值作为计算依据。计算温度差(t₂ - t₁)。
③生成1 mol水时放出的热量为______kJ。
答案:
(1)强酸 强碱
(2)温度计 玻璃搅拌器
(3)①量筒 内筒 温度计 盐酸 酸 量筒 温度计 NaOH溶液 ②迅速 内筒 立即 温度计 匀速 最高 ③两
(4)①平均 ②平均 ③0.418(t₂ - t₁)/0.025
(1)强酸 强碱
(2)温度计 玻璃搅拌器
(3)①量筒 内筒 温度计 盐酸 酸 量筒 温度计 NaOH溶液 ②迅速 内筒 立即 温度计 匀速 最高 ③两
(4)①平均 ②平均 ③0.418(t₂ - t₁)/0.025
[判一判]
(1)浓硫酸与NaOH溶液反应生成1 mol H₂O(l),放出的热量为57.3 kJ ( )
(2)中和反应反应热的测定实验中的玻璃搅拌器换成铜质搅拌器效果更好 ( )
(3)中和反应反应热的测定实验中,应将50 mL 0.55 mol·L⁻¹ NaOH溶液分多次倒入小烧杯 ( )
(1)浓硫酸与NaOH溶液反应生成1 mol H₂O(l),放出的热量为57.3 kJ ( )
(2)中和反应反应热的测定实验中的玻璃搅拌器换成铜质搅拌器效果更好 ( )
(3)中和反应反应热的测定实验中,应将50 mL 0.55 mol·L⁻¹ NaOH溶液分多次倒入小烧杯 ( )
答案:
(1)×
(2)×
(3)×
(1)×
(2)×
(3)×
2. 焓变:______条件下进行的化学反应的反应热等于焓变,符号为______,单位为______或______。
答案:
等压 ΔH kJ/mol kJ·mol⁻¹
3. 焓变的正、负:当反应体系放热时其焓减小,ΔH为______,即ΔH______0;当反应体系吸热时其焓增大,ΔH为______,即ΔH______0。
答案:
负值 < 正值 >
5. 微观角度理解反应热
以H₂(g)+Cl₂(g)═2HCl(g)反应的能量变化为例说明,如图所示:
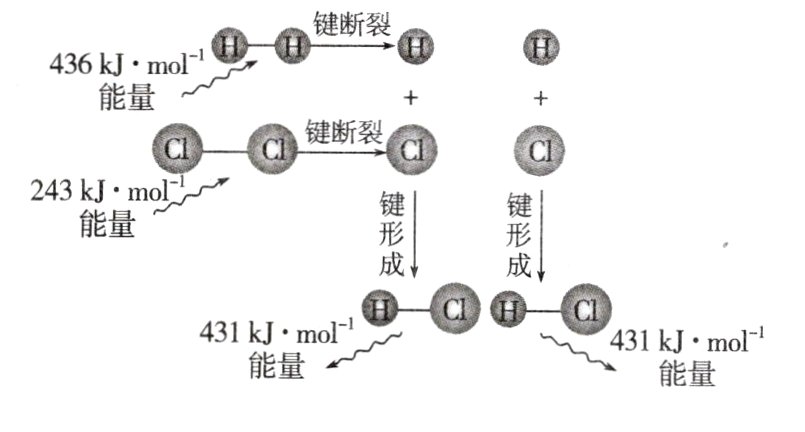
由图可知:
|化学键|反应中能量变化|
| ---- | ---- |
| |断裂或形成1 mol化学键的能量变化|断裂或形成化学键的总能量变化|
|H - H|吸收____kJ|共吸收____kJ|
|Cl - Cl|吸收____kJ| |
|H - Cl|放出____kJ|共放出____kJ|
|结论|H₂(g)+Cl₂(g)═2HCl(g)的反应热ΔH =______|
化学反应过程中形成化学键、断裂化学键能量变化可用如图表示:
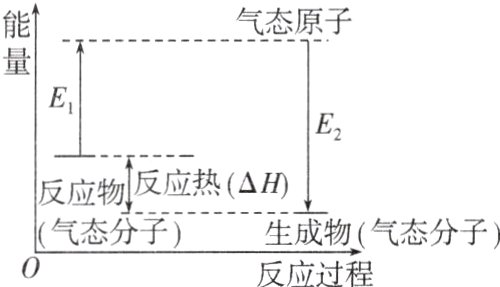
其中,E₁可看作反应物断裂化学键吸收的总能量,E₂可看作生成物形成化学键放出的总能量,E₁与E₂的差值表示______。上述反应过程表示该反应为______反应。
以H₂(g)+Cl₂(g)═2HCl(g)反应的能量变化为例说明,如图所示:

由图可知:
|化学键|反应中能量变化|
| ---- | ---- |
| |断裂或形成1 mol化学键的能量变化|断裂或形成化学键的总能量变化|
|H - H|吸收____kJ|共吸收____kJ|
|Cl - Cl|吸收____kJ| |
|H - Cl|放出____kJ|共放出____kJ|
|结论|H₂(g)+Cl₂(g)═2HCl(g)的反应热ΔH =______|
化学反应过程中形成化学键、断裂化学键能量变化可用如图表示:

其中,E₁可看作反应物断裂化学键吸收的总能量,E₂可看作生成物形成化学键放出的总能量,E₁与E₂的差值表示______。上述反应过程表示该反应为______反应。
答案:
436 243 679 431 862 -183 kJ·mol⁻¹ 反应热 放热
查看更多完整答案,请扫码查看


