2025年暑假生活北京师范大学出版社高一化学人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假生活北京师范大学出版社高一化学人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
一、硫
1. 物理性质
硫(俗称
2. 化学性质
(1)硫单质的氧化性表现为与金属单质、$H_{2}$反应
与$Fe$、$Cu$、$H_{2}$反应的化学方程式分别为
(2)硫单质的还原性表现为与$O_{2}$反应
与$O_{2}$反应的化学方程式为
1. 物理性质
硫(俗称
硫黄
)是一种黄色晶体,质脆,易研成粉末。硫难
溶于水,微溶于酒精
,易溶于二硫化碳
。2. 化学性质
(1)硫单质的氧化性表现为与金属单质、$H_{2}$反应
与$Fe$、$Cu$、$H_{2}$反应的化学方程式分别为
$ S + Fe \xlongequal{\triangle} FeS $
、$ S + 2Cu \xlongequal{\triangle} Cu_2S $
、$ S + H_2 \xlongequal{\triangle} H_2S $
,在这些反应中,$S$均作氧化剂
。(2)硫单质的还原性表现为与$O_{2}$反应
与$O_{2}$反应的化学方程式为
$ S + O_2 \xlongequal{点燃} SO_2 $
,反应中$S$作还原剂
。
答案:
1. 硫黄 难 酒精 二硫化碳
2.
(1) $ S + Fe \xlongequal{\triangle} FeS $ $ S + 2Cu \xlongequal{\triangle} Cu_2S $ $ S + H_2 \xlongequal{\triangle} H_2S $ 氧化剂
(2) $ S + O_2 \xlongequal{点燃} SO_2 $ 还原剂
2.
(1) $ S + Fe \xlongequal{\triangle} FeS $ $ S + 2Cu \xlongequal{\triangle} Cu_2S $ $ S + H_2 \xlongequal{\triangle} H_2S $ 氧化剂
(2) $ S + O_2 \xlongequal{点燃} SO_2 $ 还原剂
二、二氧化硫
1. 物理性质
二氧化硫是一种无色、有
2. 化学性质
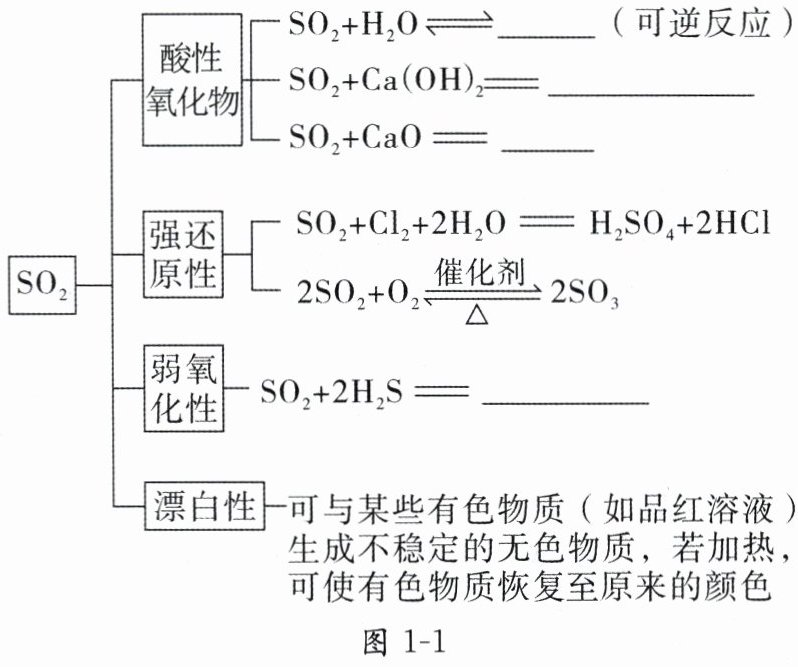
1. 物理性质
二氧化硫是一种无色、有
刺激性
气味的气体,密度比空气的大
,易溶于水。2. 化学性质

$ H_2SO_3 $ $ CaSO_3 \downarrow + H_2O $ $ CaSO_3 $ $ 3S + 2H_2O $
答案:
1. 刺激性 大
2. $ H_2SO_3 $ $ CaSO_3 \downarrow + H_2O $ $ CaSO_3 $ $ 3S + 2H_2O $
2. $ H_2SO_3 $ $ CaSO_3 \downarrow + H_2O $ $ CaSO_3 $ $ 3S + 2H_2O $
三、硫酸
1. 工业制硫酸的原理示意图
上述流程涉及的反应的化学方程式为
2. 浓硫酸的特性
(1)吸水性
浓硫酸能吸收存在于周围环境中的
(2)脱水性
浓硫酸能将蔗糖、纸张、棉布和木材等有机物中的
(3)强氧化性
浓硫酸与金属$Cu$反应的化学方程式为
浓硫酸与木炭反应的化学方程式为
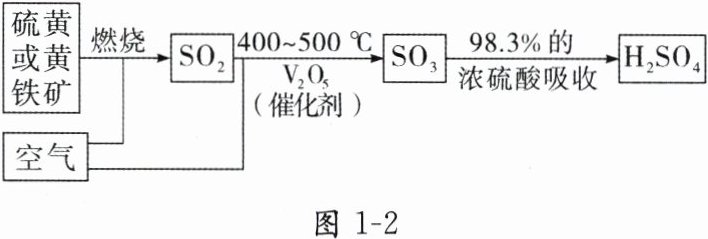
1. 工业制硫酸的原理示意图

上述流程涉及的反应的化学方程式为
$ S + O_2 \xlongequal{点燃} SO_2 $
或$4FeS_{2}+11O_{2}\overset{高温}{\xlongequal{\;\;}}2Fe_{2}O_{3}+8SO_{2}$,$ 2SO_2 + O_2 \xlongequal[V_2O_5]{400 \sim 500^{\circ}C} 2SO_3 $
,$ SO_3 + H_2O = H_2SO_4 $
。2. 浓硫酸的特性
(1)吸水性
浓硫酸能吸收存在于周围环境中的
水分
,可用作干燥剂
。(2)脱水性
浓硫酸能将蔗糖、纸张、棉布和木材等有机物中的
氢
和氧
按水的组成比脱去。(3)强氧化性
浓硫酸与金属$Cu$反应的化学方程式为
$ 2H_2SO_4(浓) + Cu \xlongequal{\triangle} CuSO_4 + SO_2 \uparrow + 2H_2O $
。反应中氧化剂是浓硫酸
,还原剂是$ Cu $
,还原产物是$ SO_2 $
。浓硫酸与木炭反应的化学方程式为
$ C + 2H_2SO_4(浓) \xlongequal{\triangle} CO_2 \uparrow + 2SO_2 \uparrow + 2H_2O $
。反应中氧化剂是浓硫酸
,还原剂是$ C $
,还原产物是$ SO_2 $
。
答案:
1. $ S + O_2 \xlongequal{点燃} SO_2 $ $ 2SO_2 + O_2 \xlongequal[V_2O_5]{400 \sim 500^{\circ}C} 2SO_3 $ $ SO_3 + H_2O = H_2SO_4 $
2.
(1) 水分 干燥剂
(2) 氢 氧
(3) $ 2H_2SO_4(浓) + Cu \xlongequal{\triangle} CuSO_4 + SO_2 \uparrow + 2H_2O $ 浓硫酸 $ Cu $ $ SO_2 $ $ C + 2H_2SO_4(浓) \xlongequal{\triangle} CO_2 \uparrow + 2SO_2 \uparrow + 2H_2O $ 浓硫酸 $ C $ $ SO_2 $
2.
(1) 水分 干燥剂
(2) 氢 氧
(3) $ 2H_2SO_4(浓) + Cu \xlongequal{\triangle} CuSO_4 + SO_2 \uparrow + 2H_2O $ 浓硫酸 $ Cu $ $ SO_2 $ $ C + 2H_2SO_4(浓) \xlongequal{\triangle} CO_2 \uparrow + 2SO_2 \uparrow + 2H_2O $ 浓硫酸 $ C $ $ SO_2 $
四、硫酸根离子的检验
1. 实验探究
(1)稀硫酸或$Na_{2}SO_{4}溶液\xrightarrow{BaCl_{2}溶液}$$\xrightarrow{稀盐酸}$现象为有白色沉淀生成,加稀盐酸后白色沉淀不溶解
(2)$Na_{2}CO_{3}溶液\xrightarrow{BaCl_{2}溶液}$$\xrightarrow{稀盐酸}$现象为有白色沉淀生成,加稀盐酸后白色沉淀溶解且放出气体
2. 检验$SO_{4}^{2-}$的一般思路
待测液$\xrightarrow[酸化]{先加稀盐酸}$无沉淀、无气体生成$\xrightarrow{BaCl_{2}溶液}$有白色沉淀生成
[正误判断]
(1)自然界中不存在游离态的硫单质。(
(2)$SO_{2}$具有漂白性,因此$SO_{2}$可使溴水褪色。(
(3)$SO_{2}$具有还原性,浓硫酸具有强氧化性,因此不能用浓硫酸干燥$SO_{2}$。(
(4)常温下,浓硫酸可以用铁罐储存,说明铁与浓硫酸不反应。(
1. 实验探究
(1)稀硫酸或$Na_{2}SO_{4}溶液\xrightarrow{BaCl_{2}溶液}$$\xrightarrow{稀盐酸}$现象为有白色沉淀生成,加稀盐酸后白色沉淀不溶解
(2)$Na_{2}CO_{3}溶液\xrightarrow{BaCl_{2}溶液}$$\xrightarrow{稀盐酸}$现象为有白色沉淀生成,加稀盐酸后白色沉淀溶解且放出气体
2. 检验$SO_{4}^{2-}$的一般思路
待测液$\xrightarrow[酸化]{先加稀盐酸}$无沉淀、无气体生成$\xrightarrow{BaCl_{2}溶液}$有白色沉淀生成
[正误判断]
(1)自然界中不存在游离态的硫单质。(
×
)(2)$SO_{2}$具有漂白性,因此$SO_{2}$可使溴水褪色。(
×
)(3)$SO_{2}$具有还原性,浓硫酸具有强氧化性,因此不能用浓硫酸干燥$SO_{2}$。(
×
)(4)常温下,浓硫酸可以用铁罐储存,说明铁与浓硫酸不反应。(
×
)
答案:
(1) ×
(2) ×
(3) ×
(4) ×
(1) ×
(2) ×
(3) ×
(4) ×
查看更多完整答案,请扫码查看


