【题目】元素周期律和周期表是学习化学的重要工具。下表是元素周期表的部分信息:

(1)画出硫原子结构示意图为 _________,在化学反应中易_________电子(选填“得到”或“失去”),形成_________(填粒子符号)。
(2)在第二周期中,各原子结构的共同之处是_________。
(3)9号元素与17号元素化学性质相似的原因是_________。
(4)13号元素铝的相对原子质量为27,其原子核内除有13个质子外还有_________。
(5)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的微粒结构和性质。下列各组粒子中属于等电子体的是_________(填字母序号)。
A. NO和O2 B.CO和 N2 C. SO2和 CO2 D. PO43-和SO42-
参考答案:
【答案】 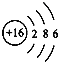 得到 S2- 电子层数相同 最外层电子数相同 14个中子(缺个数、中子之一,不得分) BD(漏1个,不得分)
得到 S2- 电子层数相同 最外层电子数相同 14个中子(缺个数、中子之一,不得分) BD(漏1个,不得分)
【解析】根据原子核外电子排布规律可知,最外层电子数多于4,一般容易得到电子,形成阴离子;元素的化学性质主要取决于最外层电子数,如果最外层电子束相同,元素的化学性质就相似,所以同一族元素化学性质相似;原子核由质子和中子构成,质子带正电,中子不带电;具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的微粒结构和性质。(1)硫原子中质子数等于电子数为16,所以硫原子结构示意图为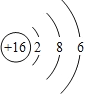 ;在化学反应中易得到2个电子,形成硫离子,符号为
;在化学反应中易得到2个电子,形成硫离子,符号为![]() ;(2)根据元素周期表的排列规律可知,同一周期电子层数相同;(3)9号元素是氟元素,17号元素是氯元素,最外层电子数都为7,所以化学性质相似;(4) 3号元素铝的相对原子质量为27,其原子核内除有13个质子外还有14个中子;(5)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的微粒结构和性质,因此所给各组中各组粒子中属于等电子体的是BD。
;(2)根据元素周期表的排列规律可知,同一周期电子层数相同;(3)9号元素是氟元素,17号元素是氯元素,最外层电子数都为7,所以化学性质相似;(4) 3号元素铝的相对原子质量为27,其原子核内除有13个质子外还有14个中子;(5)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的微粒结构和性质,因此所给各组中各组粒子中属于等电子体的是BD。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下列装置图,回答有关问题:
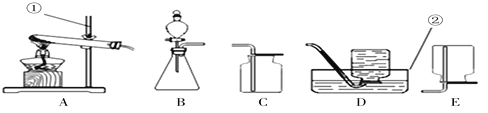
(1)请写出仪器的名称:①_________,②_______。
(2)若选用B装置作为制取氧气的发生装置,其化学方程式是_______________。
(3)用高锰酸钾制取氧气:化学方程式为_________________;如果用A作为发生装置则需________________;如果用D装置收集氧气,当气泡连续均匀冒出时才能收集的原因是______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列符号中,既能表示一个原子,又能表示一种元素,还能表示一种物质的是( )
A.H B.O2 C.Fe D.H2O
-
科目: 来源: 题型:
查看答案和解析>>【题目】给试管内的液体加热,液体体积一般不超过试管容积的( )
A. 1/2 B. 1/4 C. 1/3 D. 2/3
-
科目: 来源: 题型:
查看答案和解析>>【题目】定量研究对于化学科学发展有重大作用,因此我们应该掌握好有关质量守恒定律的相关知识。
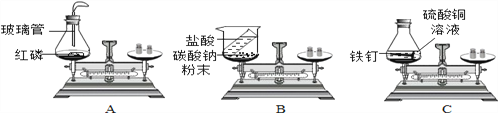
(1)在验证质量守恒定律时,下列A、B、C三个实验设计中,不能达到实验目的的是______(选填序号),理由是_______________。
(2)从微观角度分析,解释反应中,质量守恒定律成立的原因是:_____。
(3)在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表:
物质
A
B
C
D
反应前质量/g
2
24.5
4
8
反应后质量/g
16.9
0
13.6
X
表中X=______,该反应中D物质可能起了_________作用。容器内发生的反应的基本类型是_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某小组对H2O2溶液制取氧气进行了如下探究:
【探究一】:探究不同催化剂对H2O2分解快慢的影响
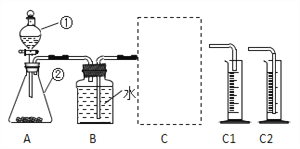
该小组采用了如下图所示装置进行实验,实验中催化剂均为0.4g,H2O2溶液浓度均为10%20mL,在C框中连接导管和量筒,并测量收集到50mL水时的某项数据,经计算后的数据如下表:
催化剂种类
气体产生速率(mL/s)
二氧化锰
3.5
氧化铜
4.5
活性炭
5.8
(1)检查A装置气密性的方法是:用弹簧夹夹住A装置右侧导气管,打开①的两个活塞,向其中加水,若___________,则气密性良好。
(2)C框内选用C1或C2装置,对该探究实验结论有无影响______。
(3)从实验数据可知:相同条件下表中催化剂的催化效果由强到弱依次为________。
(4)该探究实验中,需要测定的数据是____________。
(5)当量筒中收集到50mL水时,双氧水分解出的氧气体积______50mL(填“大于”、“等于”、“小于”)。
【探究二】:探究H2O2溶液浓度对分解速率的影响
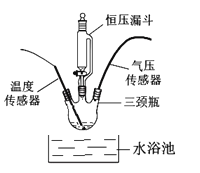
如图:在250mL三颈瓶中,加入MnO2均为0.5g,在恒压漏斗中加入不同浓度的H2O2溶液各20mL分别进行实验。并用温度传感器测量并绘制出瓶内温度与时间关系图。如下图所示。
再将该装置的三颈瓶浸入水浴池中(该池可使瓶内的溶液温度恒定在20℃),用上述实验中相同量的各物质重复上述实
验,用气压传感器测量并绘制出瓶内气压与时间关系图。如下图所示。
(6)实验中,恒压漏斗的作用是__________。
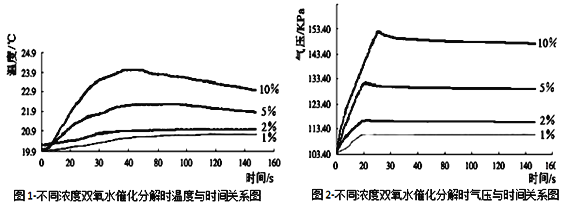
(7)由图1知道:H2O2溶液分解时会_________热量(填“放出”或“吸收”)。
(8)由图2知道: H2O2溶液浓度越高,其分解反应速率越______(填“快”或“慢”),以10%H2O2溶液为例,20S后三颈瓶内气压约由高缓慢降低的原因是_________。
(9)影响H2O2溶液分解速率的因素,除了催化剂的种类、H2O2溶液浓度外,还可能有的因素如:__________(请写出一种)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质中,前者是单质,后者是混合物的是( )
A.干冰、石油 B.水、啤酒 C.氢气、氯化钠 D.水银、石灰水
相关试题

