【题目】为了测定石灰石样品中碳酸钙的质量分数,某兴趣小组的同学称取石灰石样品52g,放于烧杯中,逐渐滴加稀盐酸,使之与样品充分反应,恰好完全反应时(杂质不参加 反应),加入稀盐酸的质量为180g,反应后烧杯中物质的总质量为210g。请计算:
(1)生成二氧化碳的质量是________g;
(2)石灰石样品中碳酸钙的质量分数(结果保留到0.1%)。
参考答案:
【答案】(1)22;(2)50g/52g=96%
【解析】分析所发生的反应,可发现反应后总质量减轻是由于生成了气体二氧化碳,根据质量守恒定律可求出二氧化碳的质量.然后利用二氧化碳的质量,根据反应的化学方程式,计算恰好完全反应时碳酸钙的质量,最后使用质量分数的计算公式,求出样品中碳酸钙的质量分数。
解:(1)生成二氧化碳的质量=52g+180g﹣210g=22g;
(2)设样品中CaCO3的质量为x。
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 22g
![]()
x=50g
石灰石样品中碳酸钙的质量分数=![]() 100%≈96.1%
100%≈96.1%
答:石灰石样品中碳酸钙的质量分数96.1%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】二氧化碳是一种宝贵的碳氧资源。以CO2和NH3合成尿素CO(NH2)2是固定和利用CO2的成功范例,该反该反应的化学方程式为CO2+2NH3=CO(NH2)2,+H2O。
请计算:
(1)尿素中C、O、N、H四种元素的质量比。
(2)若按上述方法生产120 t尿素,可固定的CO2的质量为多少。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列鉴别物质所用的方法或试剂,错误的是
A. 氧气和氮气——观察颜色 B. 酒和醋----闻气味
C. 氢氧化钠和硝酸铵—加水,测量温度变化情况 D. 氢氧化钠和盐酸——用紫色石蕊试液
-
科目: 来源: 题型:
查看答案和解析>>【题目】结合如图所示的实验装置,回答相关问题:
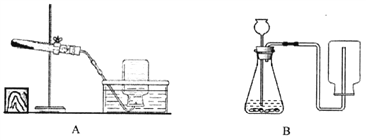
(1)若选用A装置加热高锰酸钾制取氧气,还需补充的一种仪器是___________,反应的化学方程式为______________________;
(2)实验室若选用装置B制取二氧化碳,则需要改正的一点是______________,
将二氧化碳通入澄清石灰水中变浑浊的化学方程式___________________。
(3)将制取的二氧化碳进行如下实验:
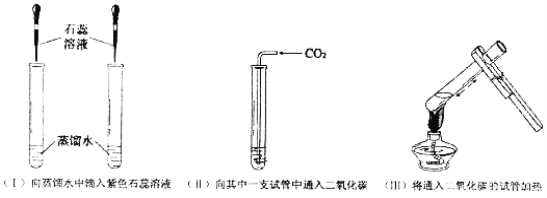
①实验(Ⅱ)中的实验现象是_______________________。
②实验(Ⅲ)中加热后又变为_____色,解释出现此现象的原因________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下表是氯化钠、硝酸钾在不同温度时的溶解度。据此判断:下列说法不正确的是
温度/℃
10
20
30
40
50
60
溶解度/g
氯化钠
35.8
36.0
36.3
36.6
37.0
37.3
硝酸钾
20.9
31.6
45.8
63.9
85.5
110
A. 氯化钠和硝酸钾的溶解度曲线在20℃~30℃温度范围内会相交
B. 在20℃时, 向68g饱和氯化钠溶液中加入32g水,此时溶液中溶质的质量分数为18%
C. 从含有少量氯化钠的饱和硝酸钾溶液中得到较多的硝酸钾晶体,可采用冷却热饱和溶液使其结晶的方法
D. 分别将20℃时一定质量的饱和氯化钠溶液、饱和硝酸钾溶液升温至40℃,此时硝酸钾溶液中溶质的质量分数大于氯化钠溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】图中A—G是初中化学常见的物质,且分别是由H、C、O、Na、S、Cu中的一种或几种元素组成。A、C为单质;B、D、E由两种元素组成,其中E中两种元素质量比为1:8;F、G、H由三种元素组成,H可用于含铅蓄电池中。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。
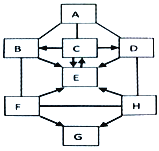
(1)写出化学式:E____________。
(2)写出B物质的一种用途:____________。
(3)写出H和D反应的化学方程式_____________。
(4)写出E→C反应的化学方程式_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质中氮元素的化合价最低的是( )
A.NaNO3 B.NO2 C.NH4Cl D.N2
相关试题

