【题目】实验结束时。同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里。如果将废液直接排放就会造成水污染。于是几位同学利用课余处理废液,回收工业重要原料硫酸锌和有关金属。实验过程如下:
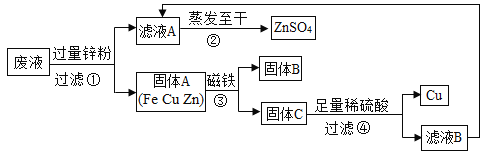
(1)滤液A和滤液B含有相同的溶质,其名称是_____;固体B的化学式为______.
(2)写出步骤①其中一个反应的化学方程式______。步骤④发生反应的化学方程式_______。
(3)要检验步骤④中加入的稀硫酸是否足量的方法是________。
(4)若实验过程中的物质损失可以忽略,要计算该废液中硫酸锌的质量分数,必须称量:废液的质量和____的质量
【答案】硫酸锌 铁 Zn+ CuSO4 == ZnSO4 + Cu,(或Zn+FeSO4= ZnSO4 +Fe) Zn+ H2SO4 == ZnSO4 + H2↑ 取步骤④的滤渣于试管中加入少量稀硫酸,若有气泡产生则酸不足量 硫酸锌的质量、锌粉的质量
【解析】
(1)将含有CuSO4、ZnSO4、FeSO4的废液回收工业重要原料硫酸锌和有关金属,滤液A和滤液B含有相同的溶质,蒸发结晶得到的晶体是硫酸锌,故滤液中的溶质是硫酸锌,铁能被磁铁吸引,固体B是铁,化学式为Fe;
(2)锌的活动性比铁和铜的活动性强,锌能与硫酸铜、硫酸亚铁反应,步骤①反应的化学方程式Zn+ CuSO4 == ZnSO4 + Cu、 Zn+FeSO4= ZnSO4 +Fe。步骤④发生反应是锌和硫酸反应生成硫酸锌和氢气,化学方程式为Zn+ H2SO4 == ZnSO4 + H2↑;
(3)步骤④中加入足量的稀硫酸的目的是将锌完全反应,所以如果硫酸足量,则所得固体中只有铜;如果酸不足,则所得固体中有铜和锌,要检验步骤④中加入的稀硫酸是否足量的方法是将步骤④所得固体中加入硫酸,如果不生成气体,说明酸足量;
(4)根据溶质的质量分数=![]() ×100%可知要计算该废液中硫酸锌的质量分数,必须称量:废液的质量和硫酸锌的质量、锌粉的质量。
×100%可知要计算该废液中硫酸锌的质量分数,必须称量:废液的质量和硫酸锌的质量、锌粉的质量。

