【题目】兴趣小组的同学用某工厂合金废料(含铝、铁、铜)制取氯化铝和硫酸铜溶液的过程如图。请你回答下列问题(铜与浓H2SO4加热时发生的反应是:.Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O):
CuSO4+SO2↑+2H2O):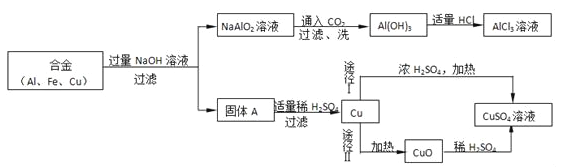
(1)合金中铝与过量NaOH溶液发生的反应是:2Al+2NaOH+2H2O=2AlNaO2+3X↑,则X的化学式是__。
(2)实验过程中多次用到过滤的操作,过滤操作中用到的玻璃仪器有:玻璃棒、烧杯和__。
(3)固体A加入适量的H2SO4的目的是__。Al(OH)3加入适量的稀HCl反应的化学方程式是__。
(4)由铜制取CuSO4溶液的途径中,CuO加入稀硫酸反应的化学方程式是__。途径Ⅱ比途径Ⅰ更好,其优点是__(答一点)。
参考答案:
【答案】H2漏斗除去铜中的铁Al(OH)3+3HCl=AlCl3+3H2OCuO+H2SO4=CuSO4+H2O没有产生有污染气体,更环保(或制取等量的CuSO4,消耗的硫酸质量少,成本低)
【解析】
(1)根据化学方程式配平方法,X的化学式是H2;(2)根据过滤实验的操作可知,用到的玻璃仪器为玻璃棒、烧杯和漏斗,故填漏斗;(3)因固体A中含有铁和铜,为了得到纯净的铜,故需要除去铜中的铁,稀硫酸可与铁反应;根据酸碱中和反应生成盐和水,故化学方程式为Al(OH)3+3HCl=AlCl3+3H2O;(4)CuO加入稀硫酸反应的化学方程式是CuO+H2SO4=CuSO4+H2O;由题干可知,途径Ⅰ反应会生成二氧化硫气体,造成污染,并且通过化学方程式计算可知生成等量的CuSO4途径Ⅱ消耗的硫酸质量更少,故途径Ⅱ比途径Ⅰ更好,其优点是没有产生有污染气体,更环保(或制取等量的CuSO4,消耗的硫酸质量少,成本低)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列曲线正确的是( )
A.
 向稀硝酸中加水
向稀硝酸中加水B.
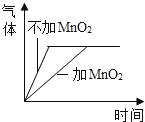 双氧水分解
双氧水分解C.
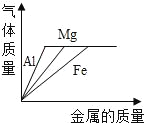 向等体积、等浓度的稀盐酸中加金属
向等体积、等浓度的稀盐酸中加金属D.
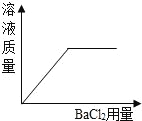 向稀硫酸中滴BaCl2溶液
向稀硫酸中滴BaCl2溶液 -
科目: 来源: 题型:
查看答案和解析>>【题目】让我们感受一下“化学生活”吧!

(1)图 A:南海盛产鱼虾,鱼虾中富含的营养素是__(填序号)。
A.糖类 B.蛋白质 C.油脂
(2)图 B:步入公园,花香四溢,说明了构成物质的微粒具有__的性质。
(3)图C和图 D 是环卫工人在公园内捡到的两种垃圾瓶罐,其中所使用的主要材料属于有机合成材料的是__(填字母序号)。
(4)我们尝了一勺汤,就知道整碗汤的味道,这体现了溶液具有均一性。厨房中的下列物质加入水中能形成溶液的是__(填序号)。
①味精 ②食用油 ③糖 ④面粉
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国科学家创造性地构建了“单中心铁催化剂”,在甲烷高效转化研究中获得重大突破,如图为该转化的微观示意图,请回答:
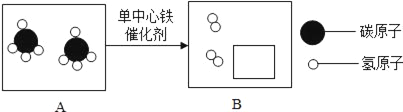
(1)A中物质的化学式为__,其中碳元素的化合价为__。
(2)B中小实线框内仅含一个分子,则该反应的化学方程式为__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙、丙三种物质的溶解度曲线如图所示.据图回答:
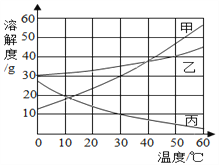
(1)30℃时,三种物质的溶解度由大到小的顺序为_____________. 要使接近饱和的丙物质溶液变为饱和,可采取的一种措施是 ______ .
(2)50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃时,析出晶体最多的是______ ,所得溶液中溶质质量分数最小的是 ______ .
-
科目: 来源: 题型:
查看答案和解析>>【题目】炎热的夏季是“登革热(dengue fever)”的高发期,防止蚊虫滋生、预防蚊虫叮咬成为预防“登革热”的重要手段。蚊虫叮咬时能在人的皮肤内分泌出蚁酸刺激皮肤。蚁酸化学名称叫甲酸,化学式为HCOOH。
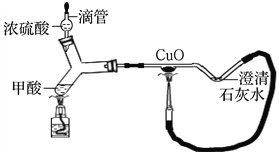
(1)向盛有蚁酸溶液的试管中滴加__________,观察到溶液中有气泡产生,说明蚁酸溶液显酸性。
(2)如图为某同学制作的微型实验装置,已知蚁酸(甲酸)在浓硫酸及加热的条件下会分解,图中_________(填现象)说明甲酸分解生成了CO;此装置的优点有:_______(写一个)
(3)被蚊虫叮咬后,在叮咬处涂抹一些物质可减轻痛痒。下列物质中,你会选择的物质是____
A.氢氧化钠溶液 B.食醋 C.苏打水 D.食盐水
-
科目: 来源: 题型:
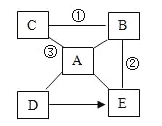
查看答案和解析>>【题目】A﹣E是初中常见的化合物,相互关系如图(“﹣﹣”表示相连的物质间在一定条件下可以发生反应,“→”表示物质在一定条件下可进行转化)A是人体胃液中含有的酸,B、C是同类物质,D、E属于不同类别的不同化合物,①②③都能产生白色沉淀,请回答下列问题:
(1)C__(填化学式);B__(填物质名称)。
(2)写出A与E反应的化学方程式:__,该反应属于__反应(基本反应类型)。
(3)写出D转化成E的化学方程式:__。
相关试题

