【题目】从下列物质中选择适当的物质填空(填字母):
A.小苏打 B.武德合金 C.硝酸钾 D.烧碱
E.维生素 F. 盐酸 G.生石灰 H.碳酸钠
(1)作食品干燥剂______;(2)作复合肥料________;
(3)胃酸主要成分______;(4)制作保险丝________;
(5)侯氏制碱中的“碱”是____;(6)蔬菜、水果中富含 _____.
参考答案:
【答案】 G C F B H E
【解析】(1)生石灰可作食品干燥剂;(2)硝酸钾可作复合肥料;(3)胃酸主要成分是盐酸;(4)合金熔点低,可制作保险丝;(5)侯氏制碱中的“碱”是碳酸钠;(6)蔬菜、水果中富含维生素。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列属于化学变化的是
A. 分离空气 B. 衣服晾干 C. 食物腐败 D. 干冰升华
-
科目: 来源: 题型:
查看答案和解析>>【题目】纯碱是化学工业生产中一种非常重要的化工原料。
反应原理:NaCl+H2O+NH3+CO2═NaHCO3↓+NH4Cl,
2NaHCO3══Na2CO3++H2O +CO2↑
已知:常温下氨气极易溶于水,1体积水大约可以溶解700体积的氨气;二氧化碳可溶于水,1体积水大约可以溶解1体积二氧化碳。
某课外活动小组模拟工业流程来制备纯碱,实验装置、所需实验药品和装置如图所示:
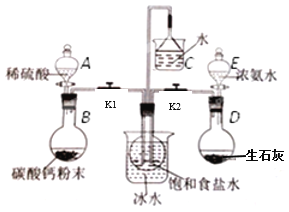
实验步骤:
(1)搭好装置并________________。
(2)中间的烧瓶中加入20mL饱和食盐水,并将其浸入冰水中; D中加入足量生石灰固体,E中加入足量浓氨水,利用该方法制取氨气的原理是_________________________(写一点即可),根据该原理,生石灰也可以用_________固体代替;B中加入足量碳酸钙粉末,A中加入足量稀硫酸于(可分多次加入),写出该反应的化学方程式________________,选择用稀硫酸而不用稀盐酸的理由是___________________________。
(3)制备NaHCO3:先打开弹簧夹________(填K1或K2),使对应一侧烧瓶中生成的气体进入饱和食盐水,大约20分钟左右时,再打开另一个弹簧夹,使其一侧的烧瓶中生成的气体进入饱和食盐水,大约5分钟即有浑浊出现,约15分钟出现大量白色固体。这种气体通入先后顺序的目的是_____________________________。
在该实验过程中,中间的烧瓶浸入冰水中的目的:___________________________。
(4)制备纯碱:欲得到纯碱,上述实验结束后,将固体过滤、洗涤后,还需进行的操作是_____;若将制得的纯碱放入足量的稀硫酸中,并将生成的气体全部通入氢氧化钠溶液中,溶液质量增加0.88g,则步骤(3)中制得的NaHCO3的质量是多少?(写出计算过程)_______
-
科目: 来源: 题型:
查看答案和解析>>【题目】氯化亚铜在工业上应用广泛。氯化亚铜(CuCl)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇。下图是工业制取氯化亚铜的生产流程图。

(1)已知反应①获得CuCl发生的是分解反应,写出该反应的化学方程式_______。
(2)用95%乙醇代替蒸馏水洗涤的主要目的是__________________________。
(3)除水以外流程中可以循环利用的物质有_____________。
(4)实验室可以用如图甲装置制备CuCl:

实验药品:铜丝20g、氯化铵20g、65%硝酸10mL、36%盐酸15mL、水。
图乙中的A、B、C三套装置均有足量的氧气生成。
①实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,最宜选择图乙中的_____装置(填字母序号A、B、C)。
②按要求在反应装置甲中放入指定的实验药品后,发现温度计显示反应液温度明显低于室温,原因可能是 _________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】用化学符号表示:
(1)锌元素 _______;(2)2个铜离子__________;
(3)最简单有机物_______;(4)人体缺少_______元素会引起佝偻病。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质是由原子直接构成的是
A. 氨气 B. 氯化钠 C. 金刚石 D. 硫酸铜
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法不正确的是
A. 高分子材料电木、电玉均具有热固性
B. 空气质量报告中所列的空气质量级别数值越小,说明空气的质量越好
C. 人体缺少钙元素时易引起甲状腺肿大
D. 磷酸二氢铵、磷酸氢二铵、硝酸钾属于复合肥料
相关试题

