【题目】某化学小组参观制碱厂后,绘制了该厂生产纯碱的工艺流程图如下,据图回答:
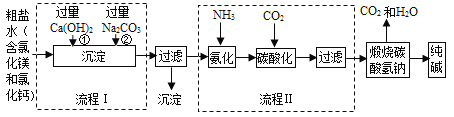
(1)流程图Ⅰ是依次向粗盐水中加入Ca(OH)2和Na2CO3,二者加入的顺序能否颠倒?______(填“能或否”),为什么___________________。
(2)过滤I得到的沉淀成分有:______________和______________(填化学式)
(3)如果不将氯化铵作为目标产品,即加入氨气不是为了生产出氯化铵,那么,氨气在制碱过程中的作用_______________________。
(4)流程Ⅱ发生的反应方程式为:___________________________
(5)20℃时,向100g水中加入11.7g氯化钠和15.8g碳酸氢铵,充分反应后,理论上从溶液中析出晶体的质量为_______g 。(20℃时碳酸氢钠的溶解度为9.7g,氯化铵的溶解度为37.2g)
参考答案:
【答案】 不能颠倒, 如果颠倒,过量的氢氧化钙和新生成的氯化钙无法除去 Mg(OH)2 CaCO3 使溶液显碱性,增大二氧化碳的吸收量 NaCl+H2O+NH3+CO2==NaHCO3+NH4Cl 7.1g
【解析】(1)依次向粗盐水中加入Ca(OH)2和Na2CO3的顺序不能颠倒,如果颠倒,过量的氢氧化钙和新生成的氯化钙将无法除去。(2)MgCl2 + Ca(OH)2 ==Mg(OH)2↓+ CaCl2,Na2CO3 + Ca(OH)2 == CaCO3↓+ 2NaOH,Na2CO3 + CaCl2 == CaCO3↓+ 2NaCl,所以过滤I得到的沉淀成分有Mg(OH)2和CaCO3(3)氨气易溶于水形成氨水,氨水属于碱,使溶液碱性增强,增大二氧化碳的吸收量。(4)根据化学反应前后元素的种类不变,流程Ⅱ发生的反应方程式为:NaCl+H2O+NH3+CO2==NaHCO3+NH4Cl (5)20℃时,NaCl的溶解度是36g,所以100g水中最多溶解36gNaCl,向100g水中加入11.7g氯化钠,不会析出晶体;NaCl+NH4HCO3==NaHCO3+NH4Cl,根据化学方程计算可知,11.7g氯化钠和15.8g碳酸氢铵恰好反应,设生成NaHCO3的质量为x,NH4Cl的质量为y
NaCl+NH4HCO3==NaHCO3+NH4Cl
79 84 53.5
15.8g x y
![]() =
=![]() ,解得x=16.8g,
,解得x=16.8g, ![]() =
=![]() ,解得y=10.7g
,解得y=10.7g
20℃时氯化铵的溶解度为37.2g,故无氯化铵析出,20℃时碳酸氢钠的溶解度为9.7g,所以析出碳酸氢钠的质量是:16.8g-9.7g=7.1g
-
科目: 来源: 题型:
查看答案和解析>>【题目】右图为甲、乙两种固体物质的溶解度曲线,下列说法正确的是
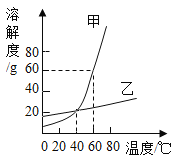
A.20℃时,甲物质的溶解度比乙物质的溶解度小
B.甲物质中混有少量乙物质,采用蒸发结晶的方法提纯甲物质
C.40℃时,甲、乙两种物质的饱和溶液中溶质质量分数相等
D.60℃时,将80g甲物质放入100g 水中,所得溶液中溶质质量与溶剂质量之比是 4:5
-
科目: 来源: 题型:
查看答案和解析>>【题目】烧杯中盛有一定质量的MgO 和MgCO3固体混合物中,向其中加入稀硫酸100g ,恰好完全反应,得到104g 该温度下的不饱和溶液。该不饱和溶液的质量分数最接近的是( )
A. 11.5% B. 18.9% C. 5.1% D. 25.9%
-
科目: 来源: 题型:
查看答案和解析>>【题目】水是一切生物生存所必需的,我们应该了解有关水的一些知识.
(1)硬水给生活和生产带来很多麻烦,生活中可用 来区分硬水和软水;
(2)我国是淡水资源非常有限的国家,爱护水资源是每个公民的责任和义务.下列行为属于浪费水的是 (填字母编号);
A.洗手擦香皂时不关上水龙头
B.用洗菜水浇花
C.用洗衣水冲厕所
D.用自来水不断为西瓜冲水降温
(3)下列物质分别加入蒸馏水中,用玻璃棒不断搅拌,能形成无色溶液的是 (填字母编号);
A.高锰酸钾 B.蔗糖 C.食用油
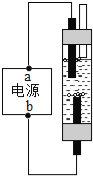
(4)如图是一种家用环保型消毒液发生器,其中发生的主要反应是氯化钠和水在通电条件下反应生成氢氧化钠、氢气和氯气(Cl2),该反应的化学方程式为 ;从能量变化角度看,该反应将 能转化为化学能.
(5)在细菌作用下,可以用氨气处理含有甲醇(CH3OH)的工业废水,有关反应的化学方程式为5CH3OH+12O2+6NH3
 3X+5CO2+19H2O,则X的化学式为 .
3X+5CO2+19H2O,则X的化学式为 . -
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示是初中常见化学物质间的转化关系(部分生成物及反应条件已略去),其中A~E均为氧化物,且A、C组成元素相同,E中两种元素的质量比为7:3,甲、乙、丙、丁均为单质。请回答下列问题:
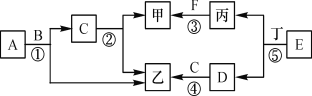
(1)F的化学式可能是 。
(2)反应①中B物质的作用是 。
(3) 反应①~⑤中属于置换反应的是 。
(4)反应⑤的化学方程式 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图1是实验室制取氧气或二氧化碳时经常用到的仪器,请回答有关问题。
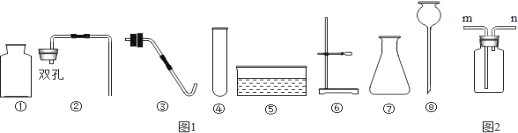
(1)写出编号仪器名称:①_____;⑧_____;
(2)当制取较多量CO2时,制取装置的仪器组合是____________(选填序号);
(3)阅读材料回答问题。资料:
①氨气是有刺激性气味的无色气体,密度比空气小,极易溶于水,其水溶液显碱性;
②加热熟石灰和氯化铵的固体混合物生成氨气;
③湿润的红色石蕊试纸遇到氨气变蓝色;氨气遇到浓盐酸时冒白烟(生成
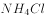 固体);
固体);Ⅰ、制取氨气的装置与实验室用_____(选填“高锰酸钾”或“双氧水”)制氧气的装置相同,还缺少的仪器名称是_____,高锰酸钾制取氧气的方程式是____________________;
Ⅱ、若用如图2装置收集氨气,进气口应为_____端(选填“m”或“n”),检验氨气集满的方法是_____;
-
科目: 来源: 题型:
查看答案和解析>>【题目】工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4
【查阅资料】(1)草酸晶体(H2C2O43H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O43H2O
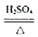 CO2↑+CO↑+H2O
CO2↑+CO↑+H2O (2)碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。
(3)铁的常见氧化物中铁的质量分数:
铁的氧化物
FeO
Fe2O3
Fe3O4
铁的质量分数
77.8%
70.0%
72.4%
【问题讨论】为了测定铁红中铁的质量分数,小组间进行如下实验。(装置气密性良好)
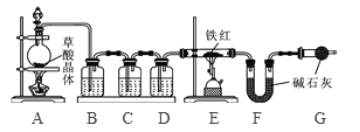
(1)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是________(填字母序号)
a.浓硫酸 b.澄清的石灰水 c氢氧化钠溶液
(2)C装置的作用是 __________________________。
(3)写出E装置中所发生反应的一个化学方程式: _____________________。
(4)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为mg,则 ____ < m < ______。
②若实验前后称得F装置増重7.7g,则此铁红中铁的质量分数是 _________。
【实验反思】 (1)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会 ________(选填“偏小”“不变”“偏大”)。
(2)该实验装置的一个明显缺陷是 ___________________。
相关试题

