【题目】(1)某学习小组为测定M硫酸厂排放的废水中的硫酸含量进行如下实验:取50 g废水于烧杯中,滴入质量分数为10%的氢氧化钠溶液(假定废水中其他成分不与氢氧化钠反应),当废水pH________(填“>7”“=7”或“<7”)时反应恰好完全,测得消耗该氢氧化钠溶液8 g,据此计算该废水中硫酸的质量分数为__________。
(2)M硫酸厂常用熟石灰对废水进行处理并产生硫酸钙,已知M厂每天用这种方法处理废水50吨,计算M厂每天理论上能产生多少吨硫酸钙?
参考答案:
【答案】 =7 1.96% (1)设废水中硫酸的溶质质量分数为x。
H2SO4+2NaOH===Na2SO4+2H2O
98 80
50 g×x 8 g×10%
![]() =
=![]() x=
x=
(2)设每天理论上生成CaSO4的质量为y。
H2SO4+Ca(OH)2===CaSO4+2H2O
98 136
50 t×1.96% y
![]() =
=![]() y=1.36 t
y=1.36 t
答:(1)该废水中硫酸的溶质质量分数为1.96%;(2)每天理论上能产生1.36吨硫酸钙。
【解析】(1)氢氧化钠和稀硫酸发生中和反应时,当废水pH=7时反应恰好完全,
设废水中硫酸的质量分数为x
H2SO4+2NaOH=Na2SO4+2H2O
98 80
50g×x 8g×10%
![]()
x=1.96%
(2)设每天理论上能产生硫酸钙质量为y
H2SO4+Ca(OH)2=CaSO4+2H2O
98 136
1.96%×50t y
![]()
y=1.36t
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是干电池的截面示意图。废旧电池也是资源,将其回收利用对保护环境具有重要意义。请结合示意图回答下列问题:
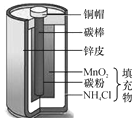
(1)碳棒(主要成分是石墨)用作电极,是利用石墨的 性。
(2)将电池填充物(MnO2、C及NH4Cl的混合物)加水溶解、过滤,可得到NH4Cl溶液。NH4Cl还可用作化肥使用,属于化肥中的 肥,其中氮元素的化合价是 。
(3)干电池中含有金属铜和锌。以下能证明铜、锌金属活动性强弱的试剂组合是 (填序号)。
A.锌、铜和稀硫酸 B.锌和氯化铜溶液 C.铜和硫酸锌溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】含有铵根离子的物质被称为农业生产中的铵态氮肥,下表是氮肥氯化铵在不同温度下的溶解度:
温度(℃)
0
10
20
30
40
50
60
70
溶解度(g/100 g水)
29.4
33.3
37.2
41.4
45.8
50.4
55.0
60.2
(1)从表可知,在70 ℃时,50克水中最多可以溶解氯化铵________克。
(2)烧杯A是70 ℃时,含有100 g水的氯化铵不饱和溶液,经过如下图的变化过程(在整个过程中,不考虑水分的蒸发),则到C烧杯时,溶液的质量为________g。

(3)下图所示是对氯化铵性质的探究实验:

①图1说明氯化铵溶于水会________热量;
②图2观察到湿润的红色石蕊试纸变________色;
③在农业生产中________(填“能”或“不能”)将铵态氮肥与碱性物质混用。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法错误的是
A.密闭容器内的水中加入硝酸铵并搅拌后温度下降,是因为硝酸铵溶于水时吸热
B.汽油能洗去油污,是因为汽油能溶解油污
C.液氧可用于火箭发射,是因为氧气具有可燃性
D.用水可以灭火,是因为降低了可燃物的温度至着火点以下
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列变化属于化学变化的是
A.葡萄酿成美酒 B.白雪缓慢消融 C.霓虹灯光闪烁 D.彩纸折成纸鹤
-
科目: 来源: 题型:
查看答案和解析>>【题目】X是一种合成纤维的原料,低毒,其化学名称为二甲苯,化学式为C8H10.下列有关说法错误的是
A.对二甲苯是由碳、氢两种元素组成
B.对二甲苯中碳、氢两种元素的质量比为4:5
C.对二甲苯的相对分子质量为106
D.对二甲苯分子由碳原子、氢原子构成
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质中存在氧分子的是 ( )
A二氧化碳 B、过氧化氢 C 空气 D高锰酸钾
相关试题

