【题目】根据下列实验要求回答问题。

(1)写出图9中仪器的名称:① ;② 。
(2)实验室制取二氧化碳的化学方程式为 ,制取装置为 (填标号,下同)和 组合。检验二氧化碳的原理为 (用化学方程式表示)。
(3)实验室用高锰酸钾制取氧气的化学方程式为 ,可选用的 发生装置为 (填标号)。
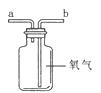
(4)若用水将图所示的氧气从瓶内排出,水须从 (填“a”或“b”)端导管口通入。
(5)实验室用碘化氢溶液测定过氧化氢溶液中溶质的质量分数,反应原理:H2O2+2HI=2H2O+I2↓。取25.0g过氧化氢溶液,加入足量的碘化氢溶液,充分反应后生成12.7g碘。根据化学方程式计算该过氧化氢溶液中溶质的质量分数。
参考答案:
【答案】(1)试管 集气瓶 (2)CaCO3+2HCl==CaCl2+H2O+CO2↑ B C CO2 +Ca(OH)2 ==CaCO3↓+ H2O (3)2KMnO4 △ K2MnO4 + MnO2 + O2↑ A (4)b (5)6.8%
【解析】
试题分析:(1) 图 中仪器的名称:①为试管;②为集气瓶;(2)实验室制取二氧化碳的化学方程式为CaCO3+2HCl==CaCl2+H2O+CO2↑;因为是固液常温下反应,故选择固液常温型装置B,生成的气体能溶于水且密度比空气大,故选择向上排空气法,装置选择C;检验二氧化碳的原理为CO2 +Ca(OH)2 ==CaCO3↓+ H2O;(3)实验室用高锰酸钾制取氧气的化学方程式为2KMnO4 △ K2MnO4 + MnO2 + O2↑,因为是固体加热制取气体,故选择固固加热型装置A,(4)用水将图10所示的氧气从瓶内排出,因为气体的密度小于水的密度,水要长进短出,故水须从b端导管口通入;(5)设过氧化氢溶液中溶质的质量分数x
H2O2+2HI=2H2O+I2↓
34 254
25.0×X 12.7
34/254= 25.0×X / 12.7
x= 6.8%
-
科目: 来源: 题型:
查看答案和解析>>【题目】某研究小组对自动充气气球(示意图如下)进行下列探究。
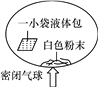
【查阅资料】该反应充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气。
(1)为检验气体是二氧化碳,可选用________________(填试剂名称)。
探究一:液体包内溶液酸碱性的探究
(2)室温时,用pH试纸测得溶液的pH=3,该溶液呈________性。
探究二:白色粉末成分的探究
【猜想与假设】甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠。
【设计并进行实验】
(1)将少量白色粉末放入水中搅拌,固体全部溶解,说明甲同学的猜想____________(填“正确”或“不正确”)。
(2)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%盐酸(装置如图),记录如下表:

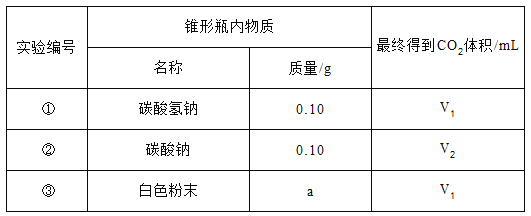
实验①的化学方程式为_________________________;表中a=_______;V1_____(填“>”“<”或“=”)V2。
【分析并得出结论】
如何从上表中获取证据并得出结论?__________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】括号内是区别下列各组常见物质的方法,其中错误的是
A.蒸馏水与盐水(过滤) B.硬水与软水(加肥皂水,振荡)
C. 面粉和葡萄糖(加水,振荡) D.白酒和食醋(闻气味)
-
科目: 来源: 题型:
查看答案和解析>>【题目】Ⅰ质量守恒定律的发现对化学的发展做出了重要贡献。
(1)通过称量下列各组试剂在密闭容器内混合前后的总质量,能验证质量守恒定律的是 (填标号)。
A.蔗糖和水 B.氯化钠溶液和硝酸钾溶液 C.铁和氯化铜溶液
(2)在氧气中点燃红磷的实验过程,固体变化如图所示。

①从燃烧条件分析,固体质量在t1前没有发生变化的原因是 。
②该反应的化学方程式为 。
③参加反应的氧气质量为 g。
(3)某反应的微观示意图如图所示:

①该反应所属的基本反应类型为 。
②参加反应的甲物质和生成的丙物质分子数目比为 。
Ⅱ.甲和乙两种固态物质的饱和溶液中溶质质量分数与温度的关系如图所示。

(1)甲和乙两种物质的溶解度随温度的升高而 (填“增大”或“减小”)。
(2)下列对P点的含义叙述正确的是 (填标号)。
A.t1℃时,甲和乙两种物质的溶解度相等
B.t1℃时,甲和乙两种物质溶液的溶质质量分数相等
C.t1℃时,甲和乙两种物质的饱和溶液中溶质的质量相等
(3)25g乙物质完全溶于100g水中所需的最低温度是 ℃。
(4)t2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是 (填“甲”或“乙”)物质饱和溶液。
-
科目: 来源: 题型:
查看答案和解析>>【题目】请沿用科学家认识事物的方式认识“空气”。
(1)从分类角度:空气属于 (填“混合物”或“纯净物”)。
(2)从微观角度:用“
 ”表示氮原子,“
”表示氮原子,“ ”表示氧原子。
”表示氧原子。①用“
 ”可表示的微粒是 (填名称)。
”可表示的微粒是 (填名称)。②同温同压下,气体的体积比等于分子数目比。若空气中其它成分忽略不计,图3可表示空气微观模型的是 (填标号)。

(3)从变化角度:
已知:常压下,氮气沸点-196℃,氧气沸点-183℃。将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是 。将该烧杯放置一段时间后,液态物质剩余约1/10体积,其主要成分是 。
(4)从应用角度:利用空气制取氮肥的流程如图4所示。

①Ⅰ中参加反应的单质甲为 。
②Ⅱ中反应的化学方程式为 。
③物质所含元素化合价发生变化的反应称为氧化还原反应。反应Ⅲ (填“属于”或“不属于”)氧化还原反应。
(5)从环保角度:下列保护空气措施合理的是 (填标号)。
A.工厂通过加高烟囱直接排放废气 B.推广使用乙醇汽油代替普通汽油
C.提倡步行、骑自行车等“低碳”出行方式
-
科目: 来源: 题型:
查看答案和解析>>【题目】观察是学习化学的重要方法之一,以下是从某同学记录的化学实验现象,其中符合事实的是( )
A.敞开浓盐酸试剂瓶口冒出白雾
B.用pH试纸测得某溶液的pH=1.4
C.铵态氮肥与碱共热放出无色无味气体
D.马铃薯片遇到碘酒后颜色不变
-
科目: 来源: 题型:
查看答案和解析>>【题目】请同学们搭乘“化学地铁”一起畅游物质世界吧!如图所示,列车上的物质可与各站的对应物质发生一步进行的反应,方可驶向下一站。“2—5号站”各站的对应物质属于不同类别的纯净物。

(1)若列车上的物质为“碳酸钠溶液”。
①列车途经“1号站”时,若指示剂为紫色石蕊溶液,溶液变 色。
②列车途经“2号站”时,若氧化物为二氧化碳,二氧化碳与碳酸钠溶液反应生成碳酸氢钠(NaHCO3)的化学方程式为 。
③列车途经“3号站”时,反应的化学方程式为 (写一个)。
(2)“碳酸钠溶液”列车抵达“4号站”时,将列车上的物质更换为“稀盐酸”后出发。
①与“碳酸钠溶液”和“稀盐酸”都能反应的“4号站”的对应物质为 (填一种)。②“稀盐酸”列车途经“5号站”时,反应的化学方程式为 (写一个)。
③“稀盐酸”列车途经“1、2、3号站”时,原“碳酸钠溶液”列车途经某站的对应物质必须更换为 (写一种物质),“稀盐酸”列车方能走完。
相关试题

