【题目】将混有少量氧化铜粉末的锌粉,放入盛有稀硫酸的烧杯中,充分反应后有部分锌粉剩余,过滤,滤液中含有的溶质是( )
A. ZnSO4 B. ZnSO4和H2SO4
C. ZnSO4和CuSO4 D. H2SO4和CuSO4
参考答案:
【答案】A
【解析】将混有少量氧化铜粉末的锌粉,放入盛有稀硫酸的烧杯中,充分反应后有部分锌粉剩余,滤液中含有的溶质是A. ZnSO4 。氧化铜与稀硫酸反应生成硫酸铜,硫酸铜与锌反应生成硫酸锌。
点睛∶本题主要考查金属与酸,盐的反应。
-
科目: 来源: 题型:
查看答案和解析>>【题目】现有四组物质的溶液,仅用酚酞试液及同组物质之间相互反应就能鉴别出来的是( )
A. NaOH、Ba(OH)2、HCl B. NaOH、HCl、NaCl
C. NaOH、HC1、HNO3 D. H2SO4、NaCl、Na2SO4
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知铜绿[Cu2(OH)2CO3]在加热时分解生成A、B、C三种常见的氧化物,下面是有关物质之间的转化关系图示(部分生成物未标出)
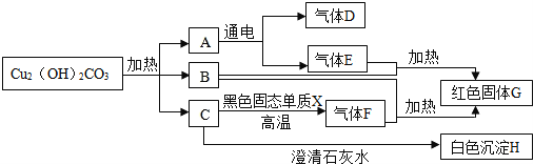
(1)试通过分析推断,确定下列物质的化学式:A________,B________,G________,H________.
(2)写出化学方程式:C→H________,E+B→G______________
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C三种物质的溶解度曲线如图所示。下列分析正确的是
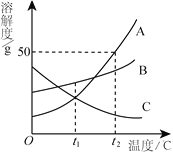
A. t1℃时,A、C两种物质的溶液中溶质的质量分数相等
B. 将接近饱和的C溶液变为饱和溶液,可采用升温的方法
C. 将t2℃时A、B两种物质的饱和溶液分别降温至t1℃,析出晶体的质量是A>B
D. t2℃时,把50gA放入50g水中能得到A的饱和溶液,其中溶质和溶液的质量比为1∶2
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下列装置图填写有关空格:
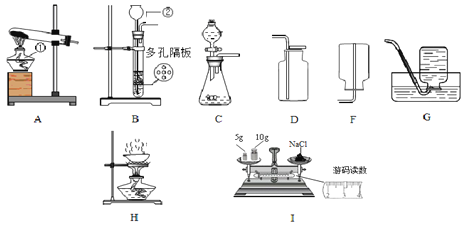
(1)仪器②的名称为___________。
(2)实验室制取二氧化碳的化学方程式为______________________,制取该气体的发生装置可选用上述_______(填序号)装置;收集二氧化碳可用 _____(填序号)装置。
(3)实验室用A装置制取氧气的化学方程式为____________________________。
(4)用氯化钠固体和水配制10%的氯化钠溶液,实验步骤是______、称量、溶解、装瓶,配制结束后发现是使用I图方法进行称量的,其他操作均规范,则所得溶液中氯化钠的质量分数为_______。(保留小数点后一位)
(5)除去粗盐中不溶性杂质的实验步骤是溶解、过滤和蒸发结晶,蒸发时用到的装置是H,该装置有一处明显的错误是__________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关碳及其氧化物的说法错误的是( )
A.CO与CO2 可用澄清石灰水区分
B.CO具有还原性,可用于铁的冶炼
C.CO2的过多排放可导致酸雨的产生
D.金刚石和石墨结构中碳原子排列方式不同
-
科目: 来源: 题型:
查看答案和解析>>【题目】某兴趣小组同学对NaOH、Na2CO3、NaHCO3、NaCl等常见的钠的化合物进行了研究。
【知识回顾】下列相关说法正确的是___。
A.NaCl主要存在于海水中
B.烧碱(NaOH)和纯碱(Na2CO3)都属于碱
C.Na2CO3和NaHCO3的俗名分别为苏打和小苏打
D.NaOH和Na2CO3都可用于治疗胃酸过多
【分析判断】电解饱和食盐水可制得“84”消毒液。你认为“84”消毒液的有效成分可能是__。
A.SO2 B. Na2CO3 C.KMnO4 D.NaClO
【提出问题】NaOH露置于空气中易变质,那么实验室中的氢氧化钠有没有变质呢?该小组同学对实验室中一瓶氢氧化钠固体样品的成分进行了探究。
【查阅资料】①NaOH在空气中不会转化成NaHCO3。
②BaCl2溶液呈中性,Ba(OH)2是可溶性碱。
③CO2在饱和的NaHCO3溶液中几乎不溶解。
【提出猜想】猜想Ⅰ:样品中只有NaOH
猜想Ⅱ:样品中只有Na2CO3
猜想Ⅲ:样品中既有NaOH又有Na2CO3
【实验探究】兴趣小组同学设计如下实验进行探究。
实验操作
实验现象与结论
1.取少量样品,加足量水。
样品全部溶解,得无色溶液。
2.取少量实验1所得无色溶液于试管中,滴加足量稀盐酸。
有气泡产生,则猜想_______(填“Ⅰ”、“Ⅱ”或“Ⅲ”)不成立。
3.取少量实验1所得无色溶液于试管中,
滴加足量BaCl2溶液。
有白色沉淀产生,有关化学方程式为_____________。
4.实验操作:__________________。
对应现象:______________,则猜想Ⅲ成立。
【定量研究】上述样品变质的程度如何呢?该兴趣小组同学设计如下图 装置测定样品中Na2CO3的质量分数。
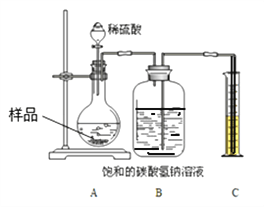
步骤如下:①按图连接好装置,并检查气密性;②准确称取该样品1.0g,放入烧瓶内;③打开分液漏斗活塞,滴加30.0%的稀硫酸至过量,关闭活塞;④反应结束后,量筒内液体的读数为55.0mL。(已知:室温条件下,CO2的密度为1.6gL﹣1)
(1)B装置集气瓶内原有的空气对实验结果_______________(填“有”或“没有”)影响。若用水代替饱和NaHCO3溶液,则所测CO2体积会偏小,原因是___________
(2)若将分液漏斗中的稀硫酸换成稀盐酸,则测试的结果可能______(填“偏大”、“偏小”或“不变”)。
(3)计算该样品中Na2CO3的质量分数((写出计算过程,结果保留到0.1%)__________。
相关试题

