【题目】某化学兴趣小组围绕“酸碱中和反应”,在老师引导下开展探究活动。
探究Ⅰ:证明氢氧化钠溶液与稀盐酸确实能发生反应。
【方案1】测定稀盐酸与NaOH溶液混合前后的pH。
测定某NaOH溶液的pH,pH大于7。将一定量的稀盐酸加入该NaOH溶液中,混合均匀后测定其pH,发现pH减小了,但仍然大于7,小组中有的同学认为根据这个测定结果可以认为稀盐酸与NaOH溶液发生了反应,你认为他们的结论是否正确: ,理由 。经过讨论后,他们向溶液中又加入一定量的稀盐酸,混合均匀后测定其pH,pH 小于7。
结论:稀盐酸与氢氧化钠溶液发生了化学反应,并且稀盐酸过量。
【方案2】借助于无色酚酞试液。
【药品仪器】

①取 (选填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用胶头滴管向①中溶液滴加稀盐酸,红色消失;
③用F蘸取②中溶液,在酒精灯上灼烧,有白色固体产生。
【思考拓展】
(1)如不使用酸碱指示剂,进一步确认步骤③中的白色固体不是氢氧化钠的方法是: ;
(2)探究步骤②中无色溶液中稀盐酸是否过量。
根据上述反应过程中溶液变成无色,不能确定稀盐酸是否过量,兴趣小组同学又分别选取了AgNO3溶液、紫色石蕊试液、铁粉设计实验方案,请你分析并判断:
实验方案 | 实验步骤 | 现 象 | 结 论 |
① | 取样,加入适量的AgNO3溶液 | 出现白色沉淀 | 稀盐酸过量 |
② | 取样,加入几滴紫色石蕊试液 | 溶液变红 | 稀盐酸过量 |
③ | 取样,加入少量铁粉 |
| 稀盐酸过量 |
方案③中反应的化学方程式 。上述设计方案中,不正确的是 (填“①”、“②”或“③”),错误的原因是 。
请你再设计一个与上述实验不同原理的方案以确定稀盐酸是否过量,你选用的试剂是 。
(3)探究Ⅱ:从微观的角度认识物质及其变化的本质。下图表示氢氧化钠溶液与盐酸反应的微观过程,该反应的本质是 结合生成水。

参考答案:
【答案】【探究Ⅰ】
【方案1】不正确,理由:滴加的盐酸中含水,加入后使NaOH溶液变稀,同样会使溶液碱性减弱,pH减小。
【方案2】①A
【思考拓展】(1)取②中溶液,向其中滴加硫酸铜溶液,无蓝色沉淀。(其它合理的也可)
(2)黑色固体溶解,产生气泡,溶液变浅绿色;(答到一点也可) Fe+2HCl=FeCl2+H2↑ ;
① 氯化钠溶液中也含Cl-,与硝酸银溶液反应也会生成白色沉淀 加入氧化铜或碳酸钠溶液(合理即可)氢离子和氢氧根离子结合成水。(3)氢离子和氢氧根离子结合成水。
【解析】
试题解析∶由题中信息知,【方案1】不正确,理由:滴加的盐酸中含水,加入后使NaOH溶
变稀,同样会使溶液碱性减弱,pH减小。【方案2】①A【思考拓展】(1)不使用酸碱指示剂,进一步确认步骤③中的白色固体不是氢氧化钠的方法是取②中溶液,向其中滴加硫酸铜溶液,无蓝色沉淀。(2)黑色固体溶解,产生气泡,溶液变浅绿色;(答到一点也可) Fe+2HCl=FeCl2+H2↑;
①氯化钠溶液中也含Cl-,与硝酸银溶液反应也会生成白色沉淀加入氧化铜或碳酸钠溶液。(3)氢离子和氢氧根离子结合成水。
-
科目: 来源: 题型:
查看答案和解析>>【题目】硫酸锌片在医药方面可用于治疗食欲不振、发育不良等症状,实验室可用锌和稀硫酸反应制得.学校化学兴趣小组的同学取一块表面严重氧化的锌片7.3g(不含其它杂质),剪碎,向其中慢慢滴加9.8%的稀硫酸,至恰好完全反应时,用去稀硫酸100g,并绘出如图所示的图象.
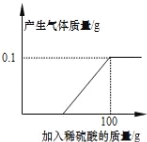
(1)小组同学在老师的指导下,配制200g 9.8%的稀硫酸.
①用98%的浓硫酸配制200g 9.8%的稀硫酸,需加水 g.
②将配制好的稀硫酸转移到试剂瓶中,贴上标签,标签上必须注明的是 (填序号).
A.200g B.9.8% C.稀硫酸
③下列操作中的 (填序号),可能会导致配制的溶液的溶质的
质量分数低于9.8%.
A.量取浓硫酸后,置于空气中时间过长
B.量水时,俯视量筒刻度
C.配制前将烧杯用水冲洗干净,没有擦干
(2)生成0.1g氢气消耗的稀硫酸的质量是多少?(请写出完整的计算过程)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是实验室常用的实验仪器与装置,根据所学知识回答下列问题:

(1)写出图中编号仪器名称:① 。
(2)用高锰酸钾制取氧气时,所选用的发生装置是 (填装置序号),该装置还需添加的实验用品为 ,反应的化学方程式为 。
若用D装置对氧气进行干燥,可将其中的水换成 。
(3)为了粗略测定加热一定质量的高锰酸钾所收集到氧气的体积,整套实验装置导管接口的正确连接顺序是 (依次填导管接口,用a、b、c……表示);
(4)实验室若用装置B制取二氧化碳,多孔隔板上常放置的药品应为 (填名称),其反应的化学方程式为 。若用过氧化氢溶液和二氧化锰粉末制取氧气, (填“能”或“不能”)用B装置控制反应的发生与停止。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是有关物质相互转化关系的示意图。其中物质A为绿色固体粉末,物质B与I组成元素相同,G为蓝色溶液,E为有机物。

(1)组成A的元素符号 ;物质E的化学式 ;
(2)反应③在自然界中称为 ;写出物质F的一种用途 ;
(3)写出反应①、②的化学方程式:
① ,
② 。
(4)上述所有转化关系中未涉及 反应(填基本反应类型)
-
科目: 来源: 题型:
查看答案和解析>>【题目】乙硫醇(化学式为 C2H6S)易挥发,有蒜臭味,人对该气体极其敏感,下列有关乙硫醇的说法不正确的是( )
A.乙硫醇的相对分子质量为 62
B.乙硫醇中 C、H、S 三种元素的质量比为 2:6:1
C.硫元素的质量分数是
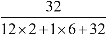 ×100%
×100% D.在管道煤气中添加微量乙硫醇,目的是及时发现煤气泄漏
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列概念中,后者不包含前者的是( )
A.非金属、单质 B.物质、纯净物
C.氧化物、含氧化合物 D.化合反应、化学反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室部分装置如下图所示,回答下列问题(制取时将 A 中的药品混合):

(1)制取并收集不同的气体,填写下表空白:
固体 M
溶液 N
制取气体
收集装置(填写字母)
大理石
CO2
锌粒
稀硫酸
B 或
O2
或 C
(2)收集干燥的 CO2 还需要用装置 E,E 中盛装的试剂为 。
(3)用上述装置 A 制取 O2 时发生反应的化学方程式为 。
相关试题

