【题目】为了测定某硫酸铜溶液的质量分数,小杨同学取50.0g样品置于烧杯中,逐滴加入氢氧化钠溶液,加入氢氧化钠溶液质量和生成沉淀质量的关系如下图所示。请计算:
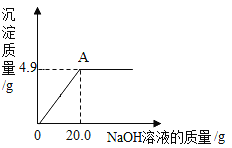
(1)NaOH的化学式量为_________。
(2)硫酸铜刚好完全反应时,所得溶液的质量为_____g(保留一位小数)。
(3)硫酸铜溶液中溶质的质量分数是________?(写出计算过程)
参考答案:
【答案】 40 65.1 16.0%
【解析】
(1)根据化学式量为化学式中的各原子的相对原子质量之和,
(2)根据质量守恒定律分析所得溶液的质量;
(3)根据氢氧化铜的质量结合化学方程式计算硫酸铜的质量,进一步计算硫酸铜溶液中溶质的质量分数。
(1)NaOH的化学式量为23+16+1=40;
(2)所得溶液的质量为50.0g+20.0g4.9g=65.1g;
(3)设样品中硫酸铜的质量为x
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
160 98
x 4.9g
![]()
x=8 g
硫酸铜溶液中溶质的质量分数为
![]()
答:硫酸铜溶液中溶质的质量分数为16.0%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知A一G均为初中化学常见的物质。I能用于改良酸性土壤,F是白色沉淀;A和G,D和E的相关信息(重叠部分表示两种物质的共同点)及它们的相互转化关系如下图(图中反应条件均已略去)。请回答下列问题:

(1)写出物质E的化学式___________, F的化学式__________ 。
(2)写出反应①的化学方程式_______________________________________,在该化学反应中,A发生的是_____________反应。
-
科目: 来源: 题型:
查看答案和解析>>【题目】工业上为提高煤的综合利用,可采用用下列流程;

(1)在加压条件下,把二氧化碳通入溶有氨气的饱和食盐水中,最终可制得一种含氯元素的氮肥_____________(填化学式)和一种水溶液显碱性的盐_________________(填化学式)。
(2)写出流程中CO与H2转化为C8H16的化学方程式________________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】梧州市某中学化学兴趣小组的同学查资料知道,乙醇(分子式为C2H6O)俗称酒精,通常情况下化学性质稳定,在一定条件下能与氧气反应。现对乙醇与氧气反应进行探究。
(探究活动一)
同学们把绕成螺旋状的红色铜丝在酒精灯的外焰上灼烧到通红,取出铜丝,发现表面变黑,趁热插入装有无水乙醇的试管中(如图),铜丝很快变为红色,并闻到刺激性气味。重复上述操作多次,得到A溶液;经称量,实验前后铜丝质量不变。

铜丝灼烧后生成的黑色物质是___,铜丝除了给反应加热外,还起到__________作用。
(提出问题) 生成的激性气味的气体是什么?
(猜想与假设)有同学提出刺激性气味的气体可能是:
猜想一:SO2猜想二:CO2。猜想三:醋酸(C2H4O2)
(讨论与结论)同学们讨论后发表看法:
小吴认为猜想一不正确,判断的依据是______________
小周认为猜想二也不正确,判断的依据是_____________
小施认为猜想三有可能正确,原因是醋酸具有挥发性,并有刺激性气味。
(探究活动二)
小施同学设计实验验证后,发现猜想三也不正确。请补充完成小施的实验操作和现象:取少量A溶液加入试管中,然后_____________
(讨论与结论)
老师提示这种刺激性气味气体来源于易挥发的B物质,其相对分子质量为44,且含有C、H、O三种元素(氢元素的质量分数不超过20%),由此可推知物质B的分子式为_____
(拓展活动)
(1)同学们再取少量A溶液加入试管中,加少量无水硫酸铜固体,变蓝色(已知:乙醇、B物质遇无水硫酸铜均不显蓝色),说明乙醇在一定条件下与氧气的反应有____生成。
(2)乙醇在微生物(醋酸菌)作用下与氧气反应能生成醋酸,写出该反应的化学方程式__________________;
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学就在我们们身边,化学与生活息息相关。
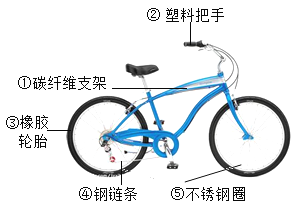
(1)自行车作为常用的代步工具具,既轻便灵活,又符合环保要求。右图是一款新型的自行车的示意图。所标部件中,属于有机合成材料的是_______(填序号,如有多项,只需选填一项,下同);属于合金的是_________ 。
(2)喝蜂蜜水可补充骑自行车所消耗的能量蜂蜜中富含六大基本营养素中的__________。
(3)青少年正处在身体发育期,除了适当的运动外,还应多喝牛奶、骨汤等,从中摄入_______元素(填一种金属元素)以促进骨骼发育。
(4)面料为“冰蚕丝”的运动服,其主要成分为合成纤维。请你用化学方法鉴别“冰蚕丝”和羊毛丝__________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示是甲物质的溶解度曲线。把甲物质的不饱和溶液变为饱和溶液,下列有关说法正确的是
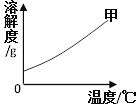
A. 溶剂的质量一定变小
B. 溶液的质量可能不变
C. 溶质的质量分数一定变大
D. 溶质的质量一定不变
-
科目: 来源: 题型:
查看答案和解析>>【题目】在甲组物质中加入乙组物质,反应过程中产生的沉淀的质量与加入乙的质量的关系,符合如图所示关系的是
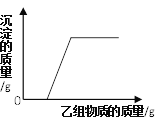
A. 甲组:硫酸钠和硫酸铜的混合溶液,乙组:氢氧化钠溶液;
B. 甲组:氯化钠和氯化钙的混合溶液,乙组:纯碱溶液;
C. 甲组:稀盐酸和氯化钡的混合溶液,乙组:纯碱溶液;
D. 甲组:稀盐酸和稀硫酸的混合溶液,乙组:氯化钡溶液;
相关试题

