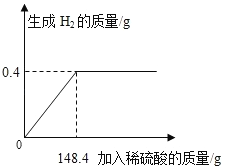
【题目】向16g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示。
求:
(1)样品中锌的质量。
(2)恰好完全反应时,所得溶液中溶质的质量分数。
参考答案:
【答案】(1)13g (2)20%
【解析】
试题本题涉及的反应Zn+H2SO4═ZnSO4+H2↑,图象为充分反应所生成氢气的质量随加入稀硫酸质量的变化情况。根据曲线可确定加入148.4g稀硫酸时与锌恰好完全反应放出0.4g氢气,运用化学方程式由氢气质量计算参加反应锌的质量及生成硫酸锌的质量,最后由质量守恒定律计算反应后所得溶液质量,完成所得溶液中溶质的质量分数的计算。
设样品中锌的质量为x,生成硫酸锌的质量为y,由图分析可知产生氢气0.4g
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.4g
![]() =
=![]() =
=![]()
x=13g y=32.2g
恰好完全反应时,所得溶液中溶质的质量分数=![]() ×100%=20%
×100%=20%
答:(1)样品中锌的质量为13g;(2)所得硫酸锌溶液中溶质的质量分数为20%
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图为几种固体的溶解度曲线,回答下列问题:

(1)NaCl的溶解度随温度变化的规律是_____;
(2)_____℃时KNO3和KCl的溶解度相等;
(3)50℃时,KCl溶液的最大浓度(列式即可)为_____;
(4)60℃时,10g NaCl和90g KNO3完全溶解于100g蒸馏水,冷却到20℃后,_____(“有”或“没有”)NaCl析出,有_____gKNO3结晶析出。
-
科目: 来源: 题型:
查看答案和解析>>【题目】3%的硼酸溶液可用于清洗皮肤的小面积创伤.现配制300g质量分数为3%的硼酸溶液,实验操作如下:
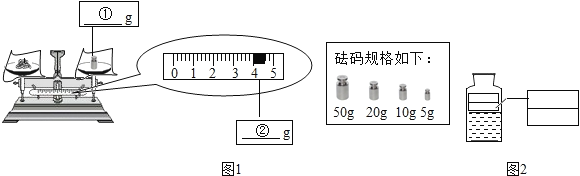
(1)称量硼酸固体的质量:在图1中分别标出所选砝码的质量和游码的示数____、____.
(2)量取水的体积:用量筒取_____mL水(ρ水≈1g/cm3).除量筒外,还须用到的一种玻璃仪器是_____.
(3)溶解:溶解时要用玻璃棒搅拌的目的是_____.
(4)装瓶、贴标签:在如图2的标签中填上相应的内容,装瓶时不慎倒出少许硼酸溶液,试剂瓶中溶液的浓度_____.(填“变大”或“变小”或“不变”)
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学做“证明鸡蛋壳的主要成分是碳酸盐,并收集纯净的气体”的实验。设计了如下方案进行实验:
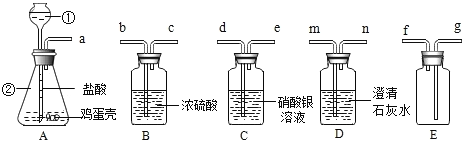
(1)写出所标仪器的名称:①_____②_____
(2)描述A中发生的现象:_____。
(3)根据我们所学的知识,你认为A装置和_____装置连接并产生什么现象时就足以说明鸡蛋壳的主要成分是碳酸盐?_____;写出该装置中发生反应的化学方程式:_____。
(4)写出用A装置还可以制取的日常生活中一种常见的气体的化学方程式:_____,并指出它的一个重要用途:_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列变化中,属于物理变化的是
A. 蛋白质遇浓硝酸早黄色B. 葡萄糖氧化
C. 用糯米酿酒D. 将小麦加工成面粉
-
科目: 来源: 题型:
查看答案和解析>>【题目】关于硫酸的说法错误的是
A. 稀硫酸与锌反应可制得氢气
B. 可将水注入浓硫酸中进行稀释
C. 稀硫酸可用于除铁锈
D. 浓硫酸可用来干燥氢气
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于氢氧化钠的描述中错误的是
A. 俗名苛性钠、火碱或烧碱
B. 氢氧化钠固体露置在空气中易变质
C. 易溶于水,溶于水时吸收大量的热
D. 是重要的化工原料,广泛应用于肥皂、纺织、印染等工业
相关试题

