【题目】化学课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:
[提出问题1] 该氢氧化钠溶液是否变质了呢?
[实验探究1]
实验操作 | 实验现象 | 实验结论 |
取少量该溶液于试管中,向溶液中滴加稀盐酸,并不断振荡。 | _____________ | 氢氧化钠溶液一定变质了。 |
[提出问题2] 该氢氧化钠溶液是全部变质还是部分变质呢?
[猜想与假设]
猜想1:氢氧化钠溶液部分变质。 猜想2:氢氧化钠溶液全部变质。
[查阅资料] ⑴ 氯化钙溶液呈中性。
⑵ 氯化钙溶液能与碳酸钠溶液反应(方程式):________________________。
[实验探究2]
实验步骤 | 实验现象 | 实验结论 |
⑴取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡。 | 有________生成 | 说明原溶液中一定有碳酸钠。 |
⑵取步骤⑴试管中的少量上层清液,滴加酚酞溶液。 | _____________ | 说明原溶液中一定有______。 |
[实验结论] 该氢氧化钠溶液_______(填“部分”或“全部”)变质。
[反思与评价] ⑴氢氧化钠溶液露置于空气中容易变质,请写出相关反应的化学方程式:_________。
⑵在上述[实验探究2]中,小明提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案________(填“可行”或“不可行”)。
[理解与应用] 氢氧化钠溶液容易变质,必须密封保存。
参考答案:
【答案】 有气泡冒出 Na2CO3+CaCl2= CaCO3![]() + 2NaCl 白色沉淀生成; 变红 氢氧化钠; 部分变质 2NaOH+CO2===Na2CO3+H2O 不可行
+ 2NaCl 白色沉淀生成; 变红 氢氧化钠; 部分变质 2NaOH+CO2===Na2CO3+H2O 不可行
【解析】氢氧化钠变质后生成碳酸钠,故加入稀盐酸后,一定有气泡冒出;
氯化钙与碳酸钠反应生成碳酸钙和氯化钠,反应方程式为Na2CO3+CaCl2= CaCO3![]() + 2NaCl
+ 2NaCl
原溶液中有碳酸钠,则加入氯化钙后有白色沉淀生成;向上清液中加入酚酞,氟变为红色,则说明一定有氢氧化钠;则说明该溶液部分变质;氢氧化钠与空气中的二氧化碳反应生成碳酸钠和水,故变质的反应方程式为2NaOH+CO2===Na2CO3+H2O
如果用氢氧化钙溶液代替氯化钙溶液,氢氧化钙本身显碱性,故会影响氢氧化钠的判断,故不能用氢氧化钙代替氯化钙;
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了节约林木资源,近几年兴起了一种含碳酸钙的“石头纸”,这种“石头纸”是用沿海水产养殖中大量废弃贝壳制得的。为测定其中碳酸钙(杂质不溶于水也不与水反应)的含量,某校化学兴趣小组的同学进行了如下实验(水和氯化氢的挥发忽略不计):取25.0 g样品粉碎放入烧杯中,加入一定质量分数的稀盐酸,所加稀盐酸的质量与生成气体的质量关系如图所示:
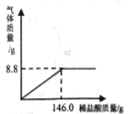
(1)计算“石头纸”中碳酸钙的质量分数。
(2)完全反应后烧杯内溶液的溶质的质量分数是多少?(结果精确到0.1%)
-
科目: 来源: 题型:
查看答案和解析>>【题目】A﹣H都是初中常见的物质,其中D为蓝色沉淀,A、E是组成元素相同的两种气体,B为红色固体,F、H为黑色固体,他们之间转化关系如下图(反应条件及部分反应物和生成物已略去 )。
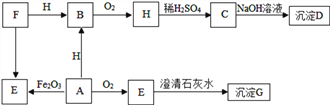
⑴C的化学式是________。
⑵写出反应H→C化学方程式____________________________。
⑶写出反应A→E化学方程式_____________________________写一个)。
⑷答出G的一种用途____________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】归纳总结是学习化学的一种方法。请结合小明同学对碱的四点化学性质的归纳图完成下列问题。(箭头上方的物质是指与碱反应的物质)
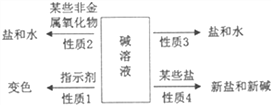
⑴碱溶液能使紫色石蕊溶液变______________。
⑵氢氧化钙溶液暴露在空气中变质的化学方程式为_____________,所以氢氧化钙必须_______保存。
⑶请帮小明补充完整性质3箭头上方的反应物质是________(填“酸”或“碱”或“盐”)。
⑷写出性质4所对就应的化学方程式______________________(写一个)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图:把气球中的镁粉加入到盛有稀盐酸的锥形瓶中,气球发生变化(实验装置的气密性良好)。下列关于本实验的说法中错误的是
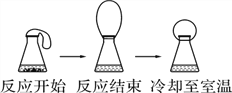
A. 本实验能说明镁与稀盐酸反应时,有气体放出
B. 本实验能说明与稀盐酸反应时,镁粉比镁条更快
C. 本实验能说明镁与稀盐酸反应有热量放出
D. 本实验能说明温度降低时,分子间的间隔变小
-
科目: 来源: 题型:
查看答案和解析>>【题目】小明用木炭粉还原氧化铜来制取铜,反应化学方程式为:______.
他根据碳的化学性质分析,认为该实验中可能会有一氧化碳产生.
【查阅资料】一氧化碳气体能使湿润的黄色氯化钯试纸变蓝色.
【设计实验】小明设计了下图所示的实验装置,并进行实验验证:
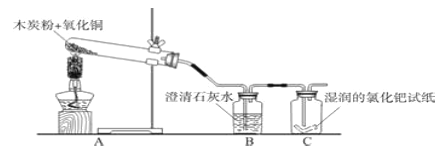
(1)A装置中酒精灯加网罩的目的是_______.
(2)刚用酒精灯给试管A加热时,B装置中就立刻产生气泡,但液体并没有浑浊的现象出现,原因是______.
(3)C中湿润黄色氯化钯试纸变蓝,说明有_____气体生成,证明小明的判断是正确的.你觉得实验产生该气体的原因可能是(写一条):______.
(4)设计装置时还要考虑环保因素,因此,要在装置C右侧导管口添加____装置.
(5)当反应结束后,小明发现一个问题:若先停止加热,______而导致试管炸裂,但若先去除B装置,则会导致________.请你帮助他设计一个实验操作,将试管中还原出的铜倒出:_________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】科学的核心是研究,科学课程通过科学探究的方式,让我们亲历科学活动,体现科学的发现过程和方法。
(Ⅰ)已知:二氧化碳气体既不溶于饱和NaHCO3溶液也不与NaHCO3反应; NaHCO3 + HCl == NaCl + H2O + CO2↑。某学生欲用浓盐酸与大理石反应制取干燥纯净的二氧化碳气体,实验室提供了下列装置和药品。请回答相关问题:
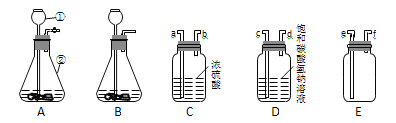
(1)仪器①的名称是__________________。
(2)实验室制取二氧化碳气体的反应原理是___________________(用化学方程式表示)。
(3)装置A、B都可作发生装置,其中可控制反应进行的是________(填装置序号)。
(4)两个净化装置相连接时,其仪器接口顺序应为______接______(填接口序号)。
(5)若用装置E收集二氧化碳气体,则气体应从______(填接口序号)进入。
(Ⅱ)下面是初三某班学生探究铁生锈实验不断完善优化的过程。

(1)优化实验时将Ⅰ中自来水换为蒸馏水目的是_____________________________。
(2)优化实验时增加Ⅳ是为证明铁生锈与空气中的_____________(填化学式)有关。
(3)实验Ⅴ在软塑料瓶中完成的,一周后可观察到铁钉生锈,_____________,同时铁钉靠近水边附近部分锈蚀得厉害。由此可知:铁生锈实际是铁与_______________(填化学式)共同作用的结果。
(4)实验Ⅵ还可用来完成______________________(填实验名称)。
相关试题

