【题目】某化学兴趣小组的同学为了测定黄铜(铜、锌合金)中锌的质量分数,取出12g合金样品,将100g稀硫酸分5次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
稀硫酸用量 | 剩余固体质量 |
第一次加入20g | 9.4g |
第二次加入20g | m g |
第三次加入20g | 4.2g |
第四次加入20g | 2.4g |
第五次加入20g | 2.4g |
(1)m值为 。(3分)
(2)求合金中锌的质量分数。(3分)
(3)求稀硫酸中溶质的质量分数。(4分)
(第(2)和(3)小题写出计算过程。)
参考答案:
【答案】(1)6.8g (3分)
(2)合金中锌的质量分数为![]() (3分)
(3分)
(3)设20g稀硫酸中含硫酸的质量为x
Zn+H2SO4= ZnSO4+ H2↑ (1分)
65 98
2.6g x
![]() (1分)
(1分)
x = 3.92g (1分)
稀硫酸中溶质的质量分数为:![]() (1分)
(1分)
答:稀硫酸中溶质的质量分数为19.6% 。
(其它合理答案酌情给分)
【解析】
试题分析:(1)加入20g稀硫酸,剩余固体9.4g即2.6g固体参与反应,因此得出质量比,那么再加入20g稀硫酸,又会有2.6g固体反应,质量再减小2.6g=6.8g;(2)铜锌合金中只有锌会与硫酸反应溶于水,因此减少的固体就是锌的质量=12g-2.4g=9.6g,那么Zn%=9.6g/12g×100%=80%;(3)溶液溶质的质量分数=溶质质量/溶液质量×100%,又溶液的均一性,因此这5份硫酸溶液的质量分数是一样的,选第一组数据(溶液中溶质硫酸完全反应)结合Zn+H2SO4= ZnSO4+ H2↑就可以得出溶质硫酸的质量,再求得质量分数。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在下列情况中:①煤的燃烧;②工业废气任意排放;③燃放鞭炮;④飞机、汽车尾气的排放,可能引起大气污染的是
A.①② B.②④ C.①②③ D.①②③④
-
科目: 来源: 题型:
查看答案和解析>>【题目】生活中的“加碘盐”、“高钙奶”、“含氟牙膏”,其中的碘、钙、氟指的是
A. 原子 B. 离子 C. 元素 D. 分子
-
科目: 来源: 题型:
查看答案和解析>>【题目】(11分)在宏观、微观和符号之间建立联系是化学学科的特点.
(1)保持氮气化学性质的最小粒子是________,保持汞的化学性质的最小粒子是 ,氯化亚铁溶液中的阳离子是 (均用化学符号表示)。
(2)如下图是钠元素和氯元素在元素周期表中的信息由此信息得出钠原子的相对原子质量为_____;氯原子的核外电子数是______ 。原子序数为17和13的两种元素形成化合物的化学式为 。

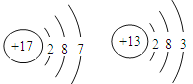
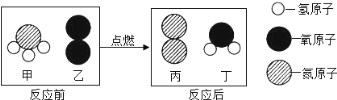
(3)在点燃条件下,甲和乙反应生成丙和丁,反应前后分子变化的微观示意图如下图,甲物质中氮元素的化合价为 ,甲与乙反应的化学方程式为: 。
(4)A、B、C、D表示4种物质,部分物质的微观示意图见下表.A和B在一定条件下反应生成C和D.请回答以下问题:若一定质量的A和4.8g的B恰好完全反应,可生成4.4gC和2.7gD,则A的化学式是______。
物质
B
C
D
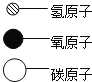
微观示意图



-
科目: 来源: 题型:
查看答案和解析>>【题目】(6分)如图是A、B、C三种物质的溶解度曲线,根据图回答下列问题:
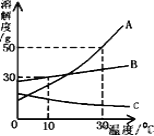
(1)30℃时向两个都盛有100g水的烧杯中,分别加入A、B两种物质至不能溶解为止,溶液的溶质质量分数较大的是 溶液(填“A”或“B””)。
(2)将10℃的A、B两种物质的饱和溶液降温至0℃,析出固体的质量大小是A B(填“>”,“<”,“=”或“无法判断”)。
(3)将10℃A、B、C饱和溶液升温至30℃,所得溶液溶质质量分数由小到大的顺序是 。
(4)A物质的饱和溶液中含有少量C物质,通过 方法可以提纯其中的A物质。
(5)10℃时将B物质20g溶于50g水,充分搅拌后所得溶液的质量为 g,溶液中溶质质量分数为 。(计算结果准确到0.1%)
-
科目: 来源: 题型:
查看答案和解析>>【题目】(9分)实验室现有氯酸钾、二氧化锰、石灰石、稀盐酸、火柴及如下图仪器:
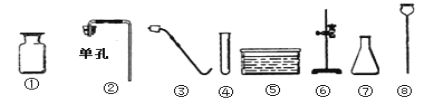
(1)仪器⑦的名称为 ;
(2)若补充一种仪器 (填名称),并利用上述部分仪器和药品可制取氧气;用排水法收集氧气时,待气泡 时,开始收集气体,制取该气体的化学方程式为 ;
(3)若要制取二氧化碳,选择的仪器为 (填序号);
(4)为检查装置的气密性,保持装置内温度不变,将导管的末端伸入装有水的烧杯中。若装置的气密性良好,烧杯内导管处的现象(画圈部分)是
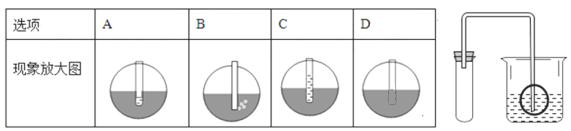
-
科目: 来源: 题型:
查看答案和解析>>【题目】当汽车油箱泄露时,采取的应急措施首先是
A.亮灯查找泄露源 B.打开车窗,严禁一切火种
C.洒水吸收汽油 D.报警说明情况
相关试题

