【题目】A、B、C、D四种化合物分别通过分解反应生成两种物质,如下所示(反应条件略去):① A → B + M ② B → M + N ③ C → M + P ④ D → M + Q在生成物中N被认为是最清洁的燃料,P是常温下为液态的金属,Q的水溶液跟硝酸银溶液反应生成一种不溶于稀硝酸的白色沉淀,试推断(用化学式表示):
(1)A是_____________B是 _____________ C是 _____________ D是 __________
(2)写出②对应的化学方程式______________________________
写出Q的水溶液跟硝酸银溶液反应的化学方程式______________反应类型______________
参考答案:
【答案】 H2O2 H2O HgO KClO3 2H2O ![]() 2H2↑+O2↑ KCl+AgNO3=AgCl↓+KNO3 复分解反应
2H2↑+O2↑ KCl+AgNO3=AgCl↓+KNO3 复分解反应
【解析】(1)在生成物中N被认为是最清洁的燃料,因此N是氢气;P是常温下为液态的金属,因此P是汞;Q的水溶液跟硝酸银溶液反应生成一种不溶于稀硝酸的白色沉淀,说明Q中含有氯离子;又因为过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,水通电分解生成氢气和氧气,氧化汞受热分解生成汞和氧气,氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气。因此A、B、C、D分别是:H2O2、H2O、HgO、KClO3;(2)水通电分解生成氢气和氧气,属于分解反应,化学方程式为:2H2O![]() 2H2↑+O2↑;氯化钾和硝酸银反应生成硝酸钾和氯化银白色沉淀,属于复分解反应,化学方程式为KCl+AgNO3═KNO3+AgCl↓,属于复分解反应。
2H2↑+O2↑;氯化钾和硝酸银反应生成硝酸钾和氯化银白色沉淀,属于复分解反应,化学方程式为KCl+AgNO3═KNO3+AgCl↓,属于复分解反应。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是甲、乙两种固体物质在水中的溶解度曲线.下列说法不正确的是
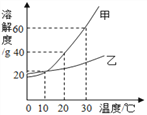
A. 10℃时,可配制溶质的质量分数均为 16%的甲、乙溶液
B. 恒温蒸发溶剂可使接近饱和的甲、乙溶液都变成饱和溶液
C. 30℃时,用质量相同的甲、乙分别与足量水配制饱和溶液,结果甲配得的饱和溶液质量大于乙
D. 20℃时,将两种饱和溶液混合在一起,所得溶液对两种溶质而言,均为不饱和溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】向装有过量锌粉的烧杯中加入一定质量AgNO3和Cu(NO3)2的混合溶液,烧杯中固体的质量随反应时间变化的情况如图所示。下列说法正确的是

A.t1时,向溶液中滴加氯化钠溶液,没有白色沉淀产生
B.t3和t5时,溶质种类不同,金属单质种类也不同
C.若向溶液中插入铝丝,铝丝表面有红色固体析出,则时间t的取值范围是:t2<t<t4
D.t2时,溶液中的金属离子有Zn2+、Cu2+,固体中的金属单质有Zn、Ag
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图中的A~E是化学实验中常用的几种装置,请按要求回答有关问题。
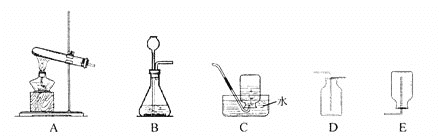
(1)利用上图中A、C装置的组合可以制取的一种气体是__________;从反应伍的状态和反应条件说明制取该气体的理由 _______________________,写出实验室制取该气体的化学方程式:____________________。
(2)若实验室制取二氧化碳气体,应选用上图中装置的组合是__________;写出实验室制取二氧化碳气体的化学方程式:____________________。
(3)写出实验室用锌与稀硫酸制取氢气的化学方程式:_________________。
(4)利用C装置,收集的气体应具有____________性质
-
科目: 来源: 题型:
查看答案和解析>>【题目】硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料。某硫酸钠粗品中含有少量的氯化钙、氯化镁,实验室进行提纯的流程如下:
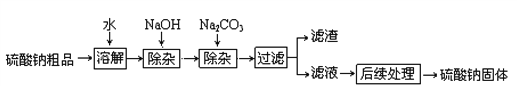
(1)滤渣中两种主要成分的化学式为 ________、____________。
(2)NaOH和Na2CO3如果添加过量了,可加入适量__________溶液除去。
(3)“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至______选填字母)。
A.完全蒸干时停止加热
B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列四个图像不能正确反映其对应实验操作的是
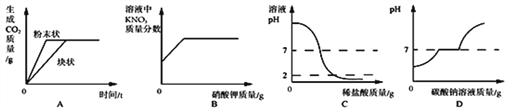
A. 图 A:等质量碳酸钙分别与等体积等质量分数的稀盐酸(足量)反应
B. 图 B:20℃时,向一定量不饱和的硝酸钾溶液中加入过量的硝酸钾晶体
C. 图 C:向一定量的氢氧化钠溶液中逐滴加入 pH=2的稀盐酸至过量
D. 图 D:向盐酸和氯化钙的混合溶液中滴加碳酸钠溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学就在我们身边,人类的衣、食、住、行都离不开化学.
⑴ 在厨房里蕴藏着许多化学知识.
①下列食物中,能提供大量蛋白质的是_______(填字母).
A.东台西瓜 B.庆丰鹅大腿 C.阜宁大糕 D.上冈猪头肉
②加铁酱油中的“铁”是指_______(填“元素”或“原子”),身体缺铁会引起贫血。
③厨房中能用来除水垢的物质是_________________.
⑵ 汽车、高铁、飞机等已成为人们出行的常用交通工具.
①汽车的铅蓄电池工作时,发生如下化学反应: Pb+PbO2+2H2SO4=2X+2H2O,该反应的中X的化学式为_____________________.
②高铁车头的玻璃是用无机玻璃、树脂、塑料等粘合而成,能耐受强大的撞击力,这种玻璃属于___(填字母).
A.无机非金属材料 B. 复合材料 C.合成材料
③制作飞机使用了硬铝(铝铜镁硅合金),其中镁元素的某种粒子结构示意图为,镁原子的最外层电子数是________.

⑶ 同学们假日到外地游玩,亲近自然,在游玩活动中,遇到一些跟化学有关的问题,请你来解答下面的问题:
①他们准备的食品因有毒而不能食用的是______________(填序号).
A.用碳酸钠代替小苏打除去发酵面团中的酸 B.霉变的米粉、花生、面包
C.用亚硝酸钠(NaNO2)代替食盐烹调的食品 D.食盐腌制的咸鸭蛋、咸猪肉
②他们在居住的宾馆房屋内看到一个木炭雕塑,可以吸收装修材料释放出的甲醛(CH2O)、苯(C6H6)等有毒气体,这是利用木炭的_______________性.
③他们看到几个农民欲将化肥硫酸铵与熟石灰混用,他们赶忙制止,其原因是_________.
相关试题

