【题目】已知a、b、c、d、e为第1﹣3周期的元素,且原子序数依次增大。b为稀有气体元素;c、d两元素可以组成两种常见化合物,在常温常压下,均为无色无味的气体,其中一种气体与血红蛋白的结合能力很强,另一种气体能使用澄清的石灰水变混浊;d为地壳里含量最多的元素;e为地壳里含量最多的金属元素。
(1)a的元素符号为:_____。
(2)b单质化学性质比较:_____(选填“稳定”或“活泼”)。
(3)c元素两种氧化物的化合价分别为:_____和_____。
(4)d元素的原子结构示意图为:_____。
(5)在空气中点燃a单质的化学方程式为:_____。
(6)e单质和稀盐酸溶液反应的化学方程式为:_____。
参考答案:
【答案】H 稳定 +2 +4 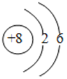 2H2 + O2
2H2 + O2![]() 2H2O 2Al + 6HCl = 2AlCl3 + 3H2↑
2H2O 2Al + 6HCl = 2AlCl3 + 3H2↑
【解析】
c、d两元素可以组成两种常见化合物,在常温常压下,均为无色无味的气体,其中一种气体与血红蛋白的结合能力很强,另一种气体能使用澄清的石灰水变浑浊,一氧化碳与血红蛋白的结合能力很强,二氧化碳能使用澄清的石灰水变浑浊,c、d两元素是碳元素和氧元素中的一种,c、d原子序数依次增大,所以c是碳,d是氧元素;e为地壳里含量最多的金属元素,e是铝元素,b为稀有气体元素,a、b、c、d、e为第1-3周期的元素,且原子序数依次增大,b是氦元素,则a是氢元素。代入原题,推理成立。
根据以上分析可知:
(1)a是氢元素,元素符号为:H;
(2)b是碳元素,其单质是碳,化学性质比较稳定;
(3)c元素两种氧化物分别为CO和CO2,氧元素的化合价为-2价,根据化合物中各元素化合价代数和为零,碳的化合价分别为:+2和 +4;
(4)d是氧元素,根据核外电子排布规律可知,第1层排2个电子,第2层排6个电子,氧原子结构示意图为: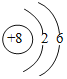 ;
;
(5)在空气中点燃氢气生成水,化学方程式为:2H2 + O2![]() 2H2O;
2H2O;
(6)铝和稀盐酸溶液反应生成氯化铝和氢气,化学方程式为:2Al + 6HCl = 2AlCl3 + 3H2↑。
-
科目: 来源: 题型:
查看答案和解析>>【题目】同学们从山上采集到一种石灰石样品,为了测定石灰石样品中碳酸钙的质量分数(石灰石中的杂质不与盐酸反应,也不溶于水),取45g石灰石样品,逐渐加入稀盐酸,充分反应后,测得剩余固体质量与加入稀盐酸的质量关系如图所示,请计算:
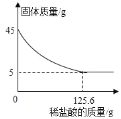
(1)45g这种石灰石样品中碳酸钙的质量是_____g
(2)本实验是否可以用稀硫酸代替稀盐酸完成实验,并说明理由_____。
(3)列式计算45g石灰石与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数?_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图为某化学反应的微观示意图,下列描述正确的是:( )
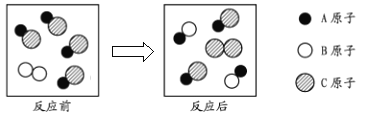
A. 某单质与某化合物之间的化合反应B. 某化合物与另一化合物之间复分解反应
C. 某单质与某化合物之间的置换反应D. 没有发生化学反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是甲、乙两物质的溶解度曲线,下列说法正确的是:( )
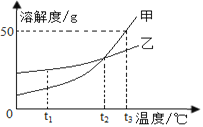
A. t3 ℃时,甲的溶解度为50
B. t2 ℃时,甲、乙溶液中溶质的质量分数相等
C. 将甲溶液从t3 ℃降温至t1 ℃,一定有晶体析出
D. 将甲、乙的饱和溶液从t2 ℃升温至t3 ℃,甲、乙溶质的质量分数相等。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知A、B、C、D是下列四种物质的一种:Fe、CuSO4、H2SO4、Ca(OH)2,且图中连线表示两种物质(或其溶液)能发生化学反应。B和C可以用来制作农用杀菌剂波尔多液。C溶液和D反应,有红色物质析出。
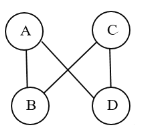
(1)B物质的俗称: __________,属于_______(填标号)。
①氧化物 ②酸 ③碱 ④盐
请举例B物质一项日常或生产中的用途:______________________ 。
(2)A和B之间的反应是_________反应(选填“吸热”或“放热”)
(3)B和C之间的反应是_________反应(填基本反应类型)
(4)C溶液和D反应的化学方程式为:________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】镁合金广泛用于航空航天、导弹、汽车、建筑等行业。镁元素的相关信息如图所示。请回答下列问题:
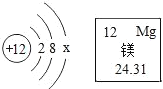
(1)镁原子的质子数为_____,x值为_____。
(2)镁属于元素_____(填“金属”或“非金属”),金属镁在化学反应在容易_____(填写“得到”或“失去”)电子。
(3)海水中含有丰富的氯化镁,目前工业上绝大多数的金属镁是从海水中提取的,其生产流程如图:
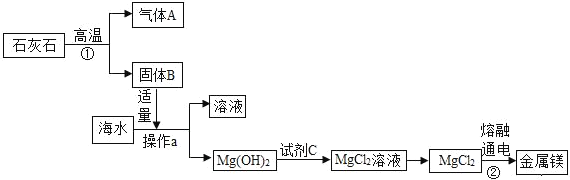
在上述流程中,通过操作a分离出固体Mg(OH)2,操作a的名称是_____,试剂C为:_____。
反应①的化学方程式为_____。
反应②的化学方程式为_____。
(4)上述流程中没有涉及到的基本反应类型是_____反应。
-
科目: 来源: 题型:
查看答案和解析>>【题目】银白色的金属钠是化学实验室中常见的药品,其化学性质十分活泼。某化学兴趣小组的同学,进行如下探究活动。
[查阅资料]
将一小块银白色的金属钠放置在空气中会发生下列变化:
钠
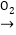 钠的氧化物
钠的氧化物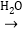 氢氧化钠溶液
氢氧化钠溶液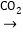 白色固体
白色固体[查阅资料]
A.钠的氧化物有氧化钠(Na2O)和过氧化钠(Na2O2),都能与水反应,反应化学方程式
如:Na2O+H2O=2NaOH;2Na2O2+2H2O=4NaOH+O2↑
B.CaCl2溶液呈中性;碳酸钠溶液能与CaCl2溶液发生复分解反应;
C.碳酸钠溶液与盐酸反应方程式有:
Na2CO3 +HCl=NaHCO3 +NaCl(盐酸量不足)
Na2CO3+2HCl=2NaCl+H2O+CO2↑(盐酸量过量)
探究一:钠的氧化物是Na2O还是Na2O2 ?
(1)为检验常温下钠与氧气反应的产物,是Na2O还是Na2O2,完成实验方案:
选取试剂
实验现象
实验结论
__________
__________
产物为Na2O
探究二:白色固体是NaOH还是Na2CO3 ?
(2) 钠在空气中放置一段时间得到白色固体的成分
猜想1:Na2CO3 猜想2:NaOH 猜想3:Na2CO3和NaOH
[实验1] 取少量白色固体加水配成溶液,再滴入几滴稀盐酸,无气泡产生。
化学小组认为:据此现象,还不能得出猜想2成立。理由是________________。
[实验2] 化学小组进行如下实验
实验操作
实验现象
实验结论
①取少量白色固体配成溶液,加入足量______
__________
猜想3成立
②过滤,取少量滤液滴入___________
__________
相关试题

