【题目】学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200 g,平均分成4份进行实验,结果如下:
实验 | 一 | 二 | 三 | 四 |
加入样品的质量/g | 5 | 10 | 15 | 20 |
生成的CO2质量/g | 1.76 | 3.52 | 4.4 | m |
(1)上表中m的数值是 ;
(2)反应中矿石有剩余是第 次实验;
(3)这种石灰石矿中碳酸钙的质量分数是 ;
(4)稀盐酸中溶质的质量分数是 .
参考答案:
【答案】(1)4.4;(2)三、四;
(3)80%;(4)14.6%.
【解析】(1)当石灰石质量为15g时,就因50g稀盐酸量不足而石灰石没完全反应,所以,石灰石增加到20g时,50g稀盐酸依然量不足,所以此时产生二氧化碳的质量仍然为4.4g;
(2)第三次实验50g稀盐酸量不足石灰石没完全反应,第四次实验石灰石增加到20g时,50g稀盐酸依然量不足而石灰石没有完全反应;故答:三、四;
(3)设10g石灰石中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 3.52g
100:44=x:3.52g 解之得 x=8g
石灰石矿中碳酸钙的质量分数=![]() =80%
=80%
(4)设生成4.4g二氧化碳消耗盐酸的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 44
y 4.4g
73:44=y:4.4g 解之得y=7.3g
稀盐酸中溶质的质量分数=![]() ×100%=14.6%
×100%=14.6%
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于溶液的说法中正确的是( )
A. 水可以溶解任何物质
B. 物质溶于水时都放出热量
C. 溶质可以是固体,也可以是液体或气体
D. 饱和溶液就是不能再溶解任何物质的溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示,田绘同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂.为了确定盐酸与氢氧化钠是否恰好完全反应,田绘从烧杯中取少量反应后的溶液放于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡后观察到酚酞试液不变色.于是她得出“两种物质已恰好完全中和”的结论.
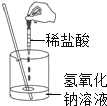
(1)你认为她得出的结论是否正确? ,理由是: .
(2)写出该中和反应的化学方程式 .
(3)请你另设计一个实验,探究上述烧杯中的溶液是否恰好完全中和,填写下表
实 验 方 法
可能观察到的现象
结 论
-
科目: 来源: 题型:
查看答案和解析>>【题目】不会影响气体在水中溶解度大小的因素是( )
A.水的温度
B.气体的压强
C.水的质量
D.气体的溶解性
-
科目: 来源: 题型:
查看答案和解析>>【题目】暖宝宝中的发热剂是铁粉、水和食盐等,发热剂能代替红磷测定空气中氧气含量(装置见如图).以下对此改进实验的叙述,错误的是
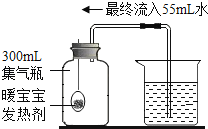
A.此实验的原理是利用铁生锈消耗氧气
B.实验前一定要检查装置的气密性
C.此实验中发热剂的多少不影响测量结果
D.此实验测出氧气的体积分数约是18.3%
-
科目: 来源: 题型:
查看答案和解析>>【题目】将下列溶液中溶质的化学式(③写名称)填在相应的短线上.
①硫酸溶液:________;②澄清石灰水:________;③碘酒:________;④锌和盐酸恰好完全反应后的溶液:________;⑤硝酸钾溶液:________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室许多药品都需密封保存,下列对药品密封保存原因的解释,错误的是( )
A.浓盐酸——防止挥发
B.NaOH溶液——防止与CO2反应
C.浓硫酸——防止吸水
D.生石灰——防止与氧气反应
相关试题

