【题目】水是一种重要的资源。请回答下列问题:
(1)打开汽水瓶盖时,汽水会自动喷出来,说明气体在水中的溶解度随_____而减小。
(2)水是一种重要的溶剂,欲配制50g溶质质量分数为10%的氯化钠溶液(水的密度是1.0g/cm3),请回答下列问题:
①称量氯化钠固体的质量为_____g;
②下列仪器中必须使用的是_____(填序号)。
A.托盘天平 B.烧杯 C.玻璃棒 D.10mL量筒 E.50mL量筒
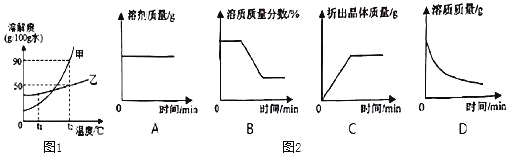
(3)甲、乙两种固体物质(不含结晶水,且不与水反应)的溶解度曲线如图1所示。
①甲、乙两种物质中溶解度受温度影响较大的是_____物质。
②若将t2℃时甲的不饱和溶液变成该温度下的饱和溶液,可采用的方法_____。(填一种即可)
③若甲物质中混有少量的乙物质,提纯甲物质可采取的方法是_____。
④t1℃时,若将25g乙固体加入50g水中,充分搅拌后,仍有9.2g乙固体未溶解,则t1℃时乙的溶解度为_____。
⑤t2℃接近饱和的甲溶液逐渐冷却至t1℃,图2中有关量随时间变化的趋势正确的是_____。(选序号)
参考答案:
【答案】压强的减小 5 g ABCE 甲 增加溶质 降温结晶 31.6g AB
【解析】
(1)气体的溶解度随压强的增大而增大,所以打开汽水瓶盖时,汽水会自动喷出来,说明气体在水中的溶解度随压强的减小而减小;
(2)溶质质量=溶液质量×溶质质量分数,所以称量氯化钠固体的质量为50g×10%=5g;
量筒需要采用就近原则,所以配制一定质量分数溶液需要的仪器有:托盘天平,烧杯,玻璃棒,50mL量筒;
(3)①通过分析溶解度曲线可知,甲、乙两种物质中溶解度受温度影响较大的是甲物质;
②若将t2℃时甲的不饱和溶液变成该温度下的饱和溶液,可采用的方法是:增加溶质;
③甲物质的溶解度受温度变化影响较大,所以若甲物质中混有少量的乙物质,提纯甲物质可采取的方法是降温结晶;
④t1℃时,若将25g乙固体加入50g水中,充分搅拌后,仍有9.2g乙固体未溶解,所以50g水中溶解的乙固体是25g﹣9.2g=15.8g,t1℃时乙的溶解度为31.6g;
⑤t2℃接近饱和的甲溶液逐渐冷却至t1℃,溶剂的质量不变,溶质质量分数先不变,再减少,后不变,开始没有晶体析出,溶质质量应该先不变,再减少,后不变所以图2中有关量随时间变化的趋势正确的是AB。
-
科目: 来源: 题型:
查看答案和解析>>【题目】取四朵用石蕊溶液染成紫色的干燥纸花完成如下实验。
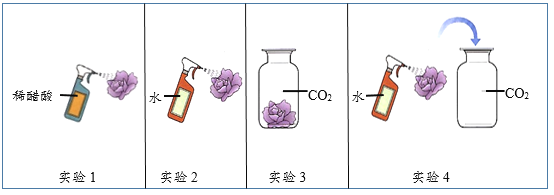
(1)纸花变为红色的实验有________(填实验序号)。
(2)实验1的作用是________。
(3)能证明水和二氧化碳发生了化学反应的现象是________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列为实验室常用的实验装置,请回答下列问题:
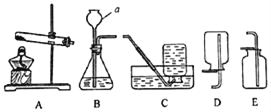
(1)仪器a的名称是:_____。
(2)实验室用氯酸钾制取氧气时,反应的化学方程式为_____,若要收集较纯净的氧气可选择的装置为_____(填序号)。
(3)用石灰石和稀盐酸制取并收集二氧化碳,选用的装置是_____(填序号),该反应的化学方程式为_____。
(4)实验室需少量氢气气体,可选择C或D装置收集。由此推断,H2所具有的物理性质是_____(填序号)。
①密度大于空气②难溶于水③密度比空气小
(5)与集气瓶配套使用的玻璃片一般一面为光滑面,另一面为磨砂面,收集气体时用玻璃片的_____盖好集气瓶(填“光滑面”或“磨砂面”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】金属材料与人类的生产和生活密切相关。请回答:
(1)教室里的电线是用铜芯制作,因为其具有良好的_____性;
(2)某款共亨单车,车身采用全铝设计。铝在空气中能形成一层致密的氧化铝薄膜,因此具有很好的抗腐蚀性。用化学方程式表示氧化铝的形成:_____;
(3)铁钉在下列哪些环境中容易生锈_____(埴序号)。
A.在干燥的空气中 B.在潮湿的空气中 C.浸没在植物油中 D.部分浸入食盐水中
写出一种防止铁制品生锈的具体方法:_____。
(4)将锌粒放入硫酸铜溶液中,锌粒表面有紫红色物质析出,还有无色无味气体产生的“异常”现象,该气体可能是_____(填序号)。
A.氢气 B.二氧化硫 C.二氧化碳 D.一氧化碳
(5)有铝粉1.8g、铜粉6.4g、铁粉11.2g、镁粉2.4g、锌粉6.5g的混合物与一定质量的稀盐酸充分反应,反应停止后有12g固体剩余,则生成氢气的质量为_____g。
(6)有Mg、Al、Fe、Cu四种金属,若两两混合,取混合物26g与足量稀硫酸反应产生1gH2,则此混合物的可能组合最多有_____组(填数字)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A﹣E是初中化学中常见的5种物质且都含有一种相同元素。B是有毒气体,白色固体E在水中的溶解度小于0.01g(20℃)。它们之间的转化关系如图所示。(“﹣”表示两端的物质能发生化学反应,“→”表示物质间在一定条件下存在转化关系,部分物质的反应条件已略去)。
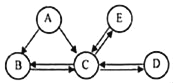
(1)写出相关的化学方程式:①A+C:_____;②C→E:_____;
(2)物质C中混有少量物质B时,可将混合物通入_____除去物质B。
(3)写出常温下,物质C与固体过氧化钠(Na2O2)反应生成碳酸钠和氧气的化学方程式_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】欲提纯某白铜(主要成分为Cu和Ni)样品中的Cu、Ni两种金属,其主要流程如图(部分反应产物在图中已略去),已知:Ni与Fe化学性质相似,常见化合价为+2价。
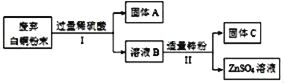
(1)固体A的化学式是_____。
(2)Ⅰ中反应的化学方程式是_____。
(3)Ⅱ中分离出固体C的操作名称是_____。
(4)由上述流程得出Cu、Ni、Zn的金属活动性由强到弱的顺序是_____。
-
科目: 来源: 题型:
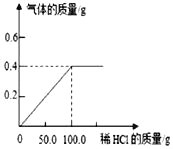
查看答案和解析>>【题目】将一定量的稀盐酸逐渐加入到30g黄铜(铜锌合金)样品中,恰好完全反应,产生气体质量与加入稀盐酸质量的关系如图所示。试计算:
(1)样品中含锌的质量;
(2)所用稀盐酸中溶质的质量分数;
(3)将反应后溶液蒸发44.6g水仍无晶体析出,计算溶液中溶质的质量分数。
相关试题

