 (2012•沐川县二模)在一节化学课上,一个精彩的实验探究正在进行:张老师向一支试管中加入氢氧化钠溶液,再逐渐滴加稀盐酸,振荡,使其充分混合.
(2012•沐川县二模)在一节化学课上,一个精彩的实验探究正在进行:张老师向一支试管中加入氢氧化钠溶液,再逐渐滴加稀盐酸,振荡,使其充分混合.[提出问题]氢氧化钠溶液和盐酸混合在一起后,我们并没有观察到明显变化,它们到底发生反应没有呢?
[猜想交流]①二者没发生反应;②二者反应了.
[设计方案]方案一:借助酚酞、石蕊的变色来验证
方案二:通过测溶液的pH值来验证
方案三:利用中和反应是放热反应来验证
[实验探究]
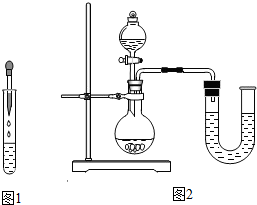
方案一:甲组同学按图1所示的方法,先向试管中加入约2mL NaOH溶液,再滴入几滴酚酞溶液,溶液变红.然后慢慢滴入稀盐酸,边滴边振荡,看到
红色逐渐消失
红色逐渐消失
,证明二者发生了反应.请指出右图操作中的错误:胶头滴管伸入到试管中去
胶头滴管伸入到试管中去
.乙组同学向氢氧化钠溶液和盐酸的混合溶液中滴加紫色石蕊溶液,观察到溶液显红色.该组实验能否证明二者发生了反应?说明理由.
不能;因为如果盐酸过量,也能使石蕊溶液变红
不能;因为如果盐酸过量,也能使石蕊溶液变红
.方案二:丙组同学先测出氢氧化钠溶液的pH值,然后在滴加稀盐酸的过程中,不断测出混合溶液的pH值,发现混合溶液的pH值在不断
减小
减小
,体现出碱性由强到弱,变成中性,直至显酸性的过程.证明二者发生了反应.若在滴入稀盐酸的过程中,观察到有少量气泡出现,则产生气泡的原因可能是可能是氢氧化钠吸收空气中的二氧化碳而变质
可能是氢氧化钠吸收空气中的二氧化碳而变质
.方案三:丁组同学在没使用温度计的情况下,通过图2装置完成了实验验证.则U形管中液面的变化情况
是
左低右高
左低右高
.你认为最合理的解释是中和反应放出的热使烧瓶内气体体积膨胀,压强增大
中和反应放出的热使烧瓶内气体体积膨胀,压强增大
.分析:[实验探究]
方案一:酚酞遇碱变红,遇酸和中性溶液不变色,石蕊遇酸变红,可以据此解答,注意胶头滴管的使用;
方案二:酸性溶液pH值小于7,中性溶液pH值等于7,碱性溶液pH值大于7,可以据此解答;氢氧化钠易变质,所以产生气泡的原因可能是氢氧化钠部分变质产生了碳酸钠;
方案三:根据物质热胀冷缩的性质来进行分析即可.
方案一:酚酞遇碱变红,遇酸和中性溶液不变色,石蕊遇酸变红,可以据此解答,注意胶头滴管的使用;
方案二:酸性溶液pH值小于7,中性溶液pH值等于7,碱性溶液pH值大于7,可以据此解答;氢氧化钠易变质,所以产生气泡的原因可能是氢氧化钠部分变质产生了碳酸钠;
方案三:根据物质热胀冷缩的性质来进行分析即可.
解答:解:方案一:酚酞遇碱变红,遇酸性和中性溶液不变色,所以可以观察到红色逐渐消失,注意在使用胶头滴管的时候,不能将胶头滴管伸入到试管中去;而乙组的实验中,如果加入的盐酸是过量的,石蕊试液要变红,所以不能判断氢氧化钠和盐酸是否发生了反应;
方案二:酸性溶液pH值小于7,中性溶液pH值等于7,碱性溶液pH值大于7,所以丙组同学先测出氢氧化钠溶液的pH值,然后在滴加稀盐酸的过程中,不断测出混合溶液的pH值,发现混合溶液的pH值在不断减小,直直至恰好完全反应时pH值为7;氢氧化钠易变质,所以产生气泡的原因可能是氢氧化钠吸收了二氧化碳而变质产生了碳酸钠;
方案三:根据物质热胀冷缩的性质可以知道,反应放出的热量使气体受热膨胀,所以U形管中的液面是左低右高.
故答案为:方案一:红色逐渐消失;胶头滴管伸入到试管中去;不能;因为如果盐酸过量,也能使石蕊溶液变红;
方案二:减小;可能是氢氧化钠吸收空气中的二氧化碳而变质;
方案三:左低右高;中和反应放出的热使烧瓶内气体体积膨胀,压强增大.
方案二:酸性溶液pH值小于7,中性溶液pH值等于7,碱性溶液pH值大于7,所以丙组同学先测出氢氧化钠溶液的pH值,然后在滴加稀盐酸的过程中,不断测出混合溶液的pH值,发现混合溶液的pH值在不断减小,直直至恰好完全反应时pH值为7;氢氧化钠易变质,所以产生气泡的原因可能是氢氧化钠吸收了二氧化碳而变质产生了碳酸钠;
方案三:根据物质热胀冷缩的性质可以知道,反应放出的热量使气体受热膨胀,所以U形管中的液面是左低右高.
故答案为:方案一:红色逐渐消失;胶头滴管伸入到试管中去;不能;因为如果盐酸过量,也能使石蕊溶液变红;
方案二:减小;可能是氢氧化钠吸收空气中的二氧化碳而变质;
方案三:左低右高;中和反应放出的热使烧瓶内气体体积膨胀,压强增大.
点评:在做中和反应的实验时,由于酸和碱的溶液一般是无色,二者反应时的现象不明显,所以往往借助于一些试剂或仪器等(如酸碱指示剂、pH试纸、温度计等),来帮助我们判断反应是否进行或恰好完全.

