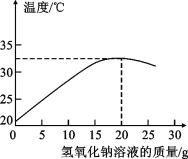
【题目】某化学兴趣小组的同学在实验室配制溶质质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数。下图表示用该氢氧化钠溶液与10g某稀盐酸发生反应时溶液温度的变化情况。试计算稀盐酸中溶质的质量分数。
参考答案:
【答案】14.6%
【解析】
试题分析:由于中和反应放热,故随着反应的进行,溶液的温度逐渐升高,直至反应恰好完全,溶液温度达到最高,故根据图示可判断,当加入氢氧化钠那溶液的质量为20g时 ,反应恰好完全
解:分析图知与10g稀盐酸恰好完全反应的氢氧化钠质量为:20g×8%=1.6g
设稀盐酸中溶质的质量为x
NaOH+HCl=NaCl+H2O
40 36.5
1.6g x
40:1.6g=36.5:x
x=1.46g
稀盐酸中溶质的质量分数为:1.46g/10g=14.6%
答:稀盐酸中溶质的质量分数为14.6%
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于水的叙述,错误的是
A、电解水时,与电源正极相连的玻璃管内得到的气体能在空气中燃烧
B、水是由氢元素和氧元素组成的
C、生活中通过煮沸可降低水的硬度
D、净化水的方法有吸附、沉淀、过滤和蒸馏等
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法符合事实的是
A、铁丝伸入盛有氧气的集气瓶中会剧烈燃烧
B、氯酸钾与二氧化锰混合后,即可产生大量氧气
C、硫燃烧后生成有刺激性气味的气体
D、铝放置在空气中不与氧气反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列描述中发生了化学变化的是( )
A.湿衣服晾干 B.灯泡通电发光
C.玻璃打碎 D.自来水厂加漂白粉消毒
-
科目: 来源: 题型:
查看答案和解析>>【题目】将X、Y、Z三种金属分别放入稀硫酸中,只有Y表面有气泡产生;将X、Z放入AgNO3溶液中,X表面有固体析出,而Z表面没有变化。根据以上事实,判断三种金属活动性由强到弱的顺序是
A、Y,X,Z B、X,Z,Y C、Y,Z,X D、X,Y,Z
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学在用氯酸钾加热制取氧气时,误把高锰酸钾当作二氧化锰作为催化剂加入到盛有氯酸钾的试管内,实验的结果与只加热氯酸钾相比( )
A.反应速率不变,放出氧气质量不变
B.反应速率不变,放出氧气质量增加
C.反应速率加快,放出氧气质量增加
D.反应速率加快,放出氧气质量不变
-
科目: 来源: 题型:
查看答案和解析>>【题目】白钨矿(主要成分为CaWO4)是一种重要的含钨矿物,CaWO4中钨元素(W)的化合价是
A、-2 B、+2 C、+4 D、+6
相关试题

