【题目】如图是元素周期表中1﹣3周期的原子结构简图和37号元素铷(元素符号为Rb)的原子结构简图:
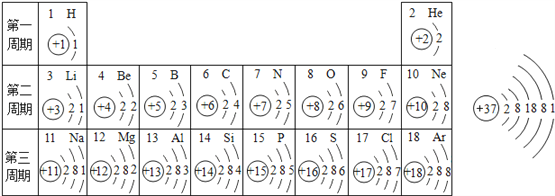
(1)在第二周期中,各元素原子结构的共同点是______________;
(2)第二、三周期中,各元素原子最外层电子数的变化规律是________________________;
(3)由1号、8号、11号元素组成的化合物X,由1号、17号元素组成的化合物Y,X与Y的水溶液会发生化学反应,其化学反应方程式为______________________________;
(4)铷在元素周期表中位于第_____周期,写出铷的氧化物的化学式__________。
参考答案:
【答案】 电子层数都是2 从左到右原子序数(质子数)依次递增(或从1到8逐渐递增) NaOH+HCl=NaCl+H2O 5 Rb2O
【解析】(1)同一周期的元素其电子层数一定相同,第二周期元素电子层是都是2层;
(2)观察表中第二、三周期各元素最外层电子数的变化可以看出最外层电子数从左到右由1递增到8;
(3)1号元素是氢元素,8号元素是氧元素,11号元素是钠元素,三种元素组成的化合物是氢氧化钠;17号元素是氯元素,与氢元素组成的化合物是氯化氢,其水溶液是盐酸,盐酸与氢氧化钠发生中和反应生成氯化钠和水,其反应方程式为NaOH+HCl=NaCl+H2O;
(4)根据电子层数等于周期数,铷的核外有5个电子层故在元素周期表中位于第5周期;铷的最外层电子数是1,故化合价为+1价,氧的化合价为-2价,故铷的氧化物的化学式Rb2O。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C是三种常见的含钙化合物,它们之间有如图所示的转化关系(部分产物略去):
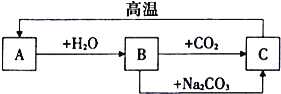
(1)A物质的化学式是___________,
B物质的俗称是___________.
(2)B的澄清溶液可用来检验二氧化碳气体,其实验现象是___________.
(3)饼干中常添加C物质,其作用是____________.
(4)写出B物质与Na2CO3反应的化学方程式___________________________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室欲测定一瓶标签破损的稀H2SO4的溶质质量分数。现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液加入,溶液的pH的变化如图所示。试回答:
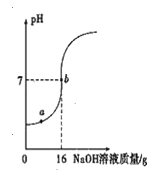
(1)a点溶液中含有的阳离子有_____________________。(用化学符号表示)
(2)当pH=7时,消耗NaOH溶液中NaOH的质量为____________。
(3)计算稀H2SO4的溶质质量分数。(写出解题过程)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列各组物质按酸、碱、盐、单质、氧化物顺序排列的是( )
A
H2SO4
Ca(OH)2
MgCl2
C
BaSO4
B
Mg(OH)2
CuSO4
CaO
S
CO2
C
MgSO4
KOH
NaCl
H2
SO3
D
HCl
NaOH
NH4Cl
O2
P2O5
A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】逻辑推理是化学学习常用的思维方法,下列推理正确的是( )
A. 水能灭火,所以电脑一旦失火应立即用水浇灭
B. 原子在化学变化中不能再分,则原子是化学变化中的最小粒子
C. 点燃H2与O2混合气体可能爆炸,但点燃煤气(CO)与O2的混合气体不可能爆炸
D. 氧化物都含有氧元素,所以含有氧元素的化合物都是氧化物
-
科目: 来源: 题型:
查看答案和解析>>【题目】荔枝是我市特产之一,荔枝肉含丰富的维生素和蛋白质等营养成分,有助于增强机体免疫功能,提高抗病能力;对大脑组织有补养作用。已知维生素A的化学式为:C20H30O。请回答:
(1)每个维生素A分子中含_____个原子;
(2)维生素A中C、H的原子个数比为_______。(最简整数比)
(3)维生素A中C、H、O元素的质量比为________。
(4)143g维生素A含氧元素的质量为____g。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(4分)如图甲是A、B、C三种固体物质的溶解度曲线图。

(1)甲图中,t2℃时,A、B、C三种物质中,溶解度最大的是 ,P点所表示的含义为 。
(2)①将t2℃时A、B、C三种物质的饱和溶液降温到t1℃时三种物质的溶质质量分数由大到小的顺序是 ;
②如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的哪一种? 。
相关试题

