【题目】某品牌洁厕灵的成分是硫酸与盐酸的混合溶液,某课外活动小组想测定该品牌洁厕灵溶液中HCl的质量.取20g该品牌的洁厕灵溶液于烧杯中,不断滴加溶质质量分数为17.1%的氢氧化钡溶液,反应过程中烧杯中产生沉淀质量和烧杯中溶液pH值变化的部分数据如表所示。(已知BaCl2溶液的pH=7)
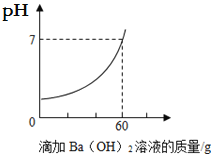
滴加氢氧化钡溶液的质量/g | 5 | 10 | 25 | 30 |
烧杯中产生沉淀的质量/g | 1.165 | 2.33 | 4.66 | 4.66 |
求:(1)完全反应后生成沉淀的质量为_______;
(2)计算该洁厕灵溶液中HCl的质量分数为多少?(计算结果保留至0.1%)
参考答案:
【答案】(1) 4.66;(2) 14.6%
【解析】(1)烧杯中产生沉淀的质量最终是4.66g,故完全反应后生成沉淀的质量为4.66g。
(2)设生成 4.66gBaSO4消耗氢氧化钡溶液的质量为y,
Ba(OH)2+ H2SO4=BaSO4↓+2H2O
171 233
y×17.1% 4.66g
![]() =
=![]() 解得y=20g
解得y=20g
所以与稀盐酸反应的氢氧化钡溶液的质量为:60g-20g=40g,设与40g氢氧化钡溶液反应的稀盐酸的溶质的质量为w,
Ba(OH)2 + 2HCl== BaCl2 ++2H2O
171 73
40g×17.1% w
![]() =
=![]() 解得w= 2.92g
解得w= 2.92g
该洁厕灵溶液中HCl的质量分数为: ![]() ×100%=14.6%
×100%=14.6%
-
科目: 来源: 题型:
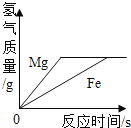
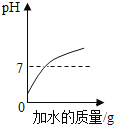
查看答案和解析>>【题目】下列四个图形的变化趋势能正确描述对应操作的是( )
A. 足量的铁片和镁条分别与等质量、等质量分数的稀盐酸反应
B. 将浓盐酸敞口放置在空气中
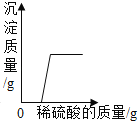
C. 向氢氧化钠和硝酸钡的混合溶液中逐滴加入稀硫酸
D. 向pH=2的盐酸溶液中加水稀释
-
科目: 来源: 题型:
查看答案和解析>>【题目】初中化学中,我们学习了酸和碱发生中和反应的实质是H++OH﹣═H2O。如图,像这种用实际参加反应的离子符号来表示反应的式子叫离子方程式。
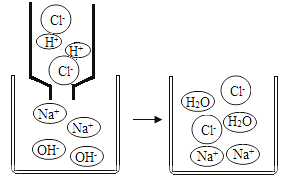
离子方程式的书写一般按以下步骤:(以Na2SO4与BaCl2反应为例)
①写出Na2SO4与BaCl2反应的化学方程式: 。
②把易溶于水、易电解的物质写成离子形式,把难溶的物质、气体和水等仍用化学式表示。上述方程式可改写成:2Na++SO42﹣+Ba2++2Cl﹣═BaSO4↓+2Na++2Cl﹣。
③删去方程式两边不参加反应的离子:Ba2++SO42﹣═BaSO4↓。
④检查方程式两边各元素的原子个数和电荷总数是否相等。
请回答:
(1)下列各组中的离子,在pH=3的水溶液中能大量共存的是 。
A.Na+、Mg2+、Cl﹣、SO4 2﹣
B.Na+、K+、Cl﹣、OH﹣
C.Na+、Cu2+、Cl﹣、SO42﹣
D.Na+、K+、Cl﹣、CO32﹣
(2)写出稀盐酸滴在石灰石上所发生反应的离子方程式 。
(3)写出一个与离子方程式Mg+2H+═Mg2++H2↑相对应的化学方程式 。
(4)酸、碱、盐在水溶液中发生的复分解反应实质上就是两种化合物在溶液中相互交换离子的反应,只要具备生成物中有气体或沉淀或 生成,反应就能发生。
-
科目: 来源: 题型:
查看答案和解析>>【题目】请结合图回答问题:

(1)写出上图中有标号仪器的名称:a_______,b______。
(2)用高锰酸钾制取一瓶氧气,可选用装置A和__________(选填序号)组合。装入药品前要先____, 该反应的化学方程式___________________________________。
(3)用双氧水和二氧化锰制氧气,二氧化锰的作用是_______,可选用的发生装置是____ (选填序号)。
(4)用如图装置制取CO2并验证相关性。

①生成CO2的化学方程式___________________________。
②F装置的作是____________________________________。
③H装置中的现象可说明CQ具有的性质是_______________ (答一点即可)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】治理污染、保护环境,事关人民群众的身体健康和社会的可持续发展。
(1)下列环境问题与燃煤有赢接关系的是 _____(填字母序号)。
a.酸雨 b.温室效应 c.可吸入颗粒物增加
(2)烟气脱硫是目前控制燃煤污染的重要途径。如钠碱循环法是利用亚硫酸钠(Na2SO3)溶液脱除烟气中的SO2,生成亚硫酸氢钠(NaHSO3),反应的化学方程式为 _____________________。
(3)烟道气中含有大量CO2,经“捕捉”可用于生产尿素、甲醇等产晶。
①尿素[CO(NH2)2]属于化学肥料中的____________肥。
②生产甲醇(CH3OH)。
“捕捉”CO2:在高压时将烟道气中的CO2溶解于甲醇,得到CO2的甲醇溶液。所得溶液中溶质是___________。
用“捕捉”CO2生产甲醇,反应的微观示意图如下:
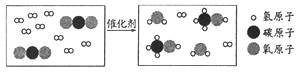
该反应的化学方程式为___________________________________。
③还可以利用NaOH溶液来“捕捉”CO2,并将CO2储存或利用,流程如下:
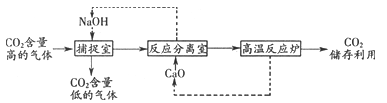
下列有关该过程的叙述正确的有__________________。
a.该过程可实现CO2零排放
b.该过程中至少有2种物质可以循环利用
C.反应分离室中分离物质的操作是蒸发、结晶
d.该过程中至少发生了4个化学反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】掌握科学的研究方法,探索化学世界的奥秘。
(1)分类是学习化学的重要方法之一。
生活中,常会接触到下列物质:A.铜丝 B.天然气 C.干冰 D.食盐水
其中属于混合物的是(填字母,下同)_____________,属于氧化物的是____________。
(2)控制变量,设计对比实验是实验探究的重要方法。_______、________、_________

(3)质量守恒定律是帮助我们学习和认识化学反应实质的重要理论。
①下列表述正确的是_________。
A.蜡烛燃烧后质量减少,说明质量守恒定律不是普遍规律
B.每32gS和32gO2完全反应后,生成64gSO2
C.在化学反应aA+bB=cC+dD中一定有:a+b=c+d
②物质X是一种可再生绿色能源,其燃烧的化学方程式为X+3O2
 2CO2+3H2O,则X的化学式为__________。
2CO2+3H2O,则X的化学式为__________。 -
科目: 来源: 题型:
查看答案和解析>>【题目】原子结构示意图可以方便简明地表示原子核外电子的排布,元素周期表是我们学习化学的重要工具。请根据图片信息判断下列说法不正确的是
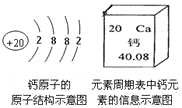
A. 钙元素的原子序数是20
B. 钙元素的离子核外最外层有2个电子
C. 钙元素的原子核所带电荷数为20
D. 钙元素的相对原子质量约为40.08
相关试题

