【题目】请结合图示实验装置,回答下列问题。

(1)写出有标号的仪器名称:①______________,②______________。
(2)用高锰酸钾制氧气选用的发生装置是________(选填序号),反应的化学方程式为________,如果选择用D装置收集气体,气体应从___________通入。
(3)实验室可用B或C装置制CO2,反应的化学方程式为____________,选用C相对于B装置的优点有_____________,若用碳酸钠粉末和稀硫酸反应制取CO2,则只能选择___________作发生装置。
(4)实验室可用加热熟石灰与氯化铵的固体混合物的方法制NH3,反应的化学方程式为_________________,用E装置收集氨气,其中植物油的作用是____________。
参考答案:
【答案】 酒精灯 分液漏斗 A 2KMnO4![]() K2MnO4 + MnO2 + O2↑ b CaCO3+2HCl==CaCl2+H2O+CO2↑ 控制反应的发生和停止 B Ca(OH)2+2NH4Cl==CaCl2+2H2O+2NH3↑ 防止氨气溶于水
K2MnO4 + MnO2 + O2↑ b CaCO3+2HCl==CaCl2+H2O+CO2↑ 控制反应的发生和停止 B Ca(OH)2+2NH4Cl==CaCl2+2H2O+2NH3↑ 防止氨气溶于水
【解析】熟知仪器名称;
用高锰酸钾制取氧气的反应装置、原理;
实验室制取二氧化碳的反应装置、原理;
装置的选择及氨气性质。
解:(1)酒精灯 分液漏斗
(2)此反应是固体加热型,故发生装置选A;反应的化学方程式为:2KMnO4△ K2MnO4+MnO2+O2↑;由于氧气的密度比空气大,所以用D装置收集气体,应从长管通入,故选b;
(3)实验室制CO2,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑。用C装置时,关闭开关时,试管中的气体增多,压强增大,把液体压入长颈漏斗,固体和液体分离,反应停止。打开开关时,气体导出,试管中气体减少,压强减小,液体和固体混合,反应进行。故选用C相对于B装置的优点是:控制反应的发生和停止。由于用的碳酸钠粉末,只能用B装置;
(4)加热熟石灰与氯化铵生成氯化钙、水、氨气。用E装置收集氨气,植物油的作用是:防止氨气溶于水。反应的化学方程式为:Ca(OH)2+2NH4Cl△CaCl2+2H2O+2NH3↑。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室加热150ml的液体,需要使用的仪器是
①烧杯 ②试管 ③酒精灯 ④石棉网 ⑤试管夹 ⑥铁架台
A.①③④⑥ B.②③④⑥ C.①③④⑤ D.②③⑤⑥
-
科目: 来源: 题型:
查看答案和解析>>【题目】固体物质溶解能力大小与下列因素有关的是(_______)
A.溶质质量 B.温度 C.溶质颗料大小 D._____________
-
科目: 来源: 题型:
查看答案和解析>>【题目】某工业废渣主要成分是Fe2O3,还含有CaCO3和SiO2(既不溶于水也不溶于稀硫酸),实验室用此废渣制备FeSO4·7H2O的流程如下:
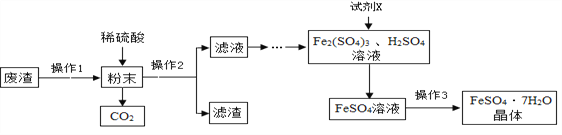
(1)试剂X应选用____________(选填序号)。
a.Cu b.Fe2O3 c.Fe d.Zn
(2)操作2中用到玻璃棒,其作用是_______________。
(3)操作3为蒸发浓缩、____________、过滤。
(4)待结晶完毕后,滤出晶体洗涤,其中洗涤剂不可选用__________(选填序号)。
a.冰水 b.沸水 c.饱和FeSO4溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】(7分)某同学将光亮的镁条放入滴有酚酞的NaHCO3饱和溶液中,产生大量气泡和白色固体,溶液红色加深。
一、溶液红色加深,则反应后溶液的碱性 (填“增强”、“不变”或“减弱”)。
二、为确定气体和固体的成分,该同学进行了如下的探究。
(1)点燃产生的气体,火焰淡蓝色;将燃烧产物通入澄清石灰水中,无现象。则该气体为 (写化学式)。
(2)对白色固体做出如下猜测并进行实验:
【猜测】
查阅资料1:Mg(HCO3)2能溶于水。
① 白色固体可能是MgCO3;
② 白色固体可能是 ;
③ 白色固体可能是MgCO3和Mg(OH)2。
【实验】
① 取洗净后的白色固体,加入足量的 溶液,观察到 ,则白色固体一定含有MgCO3。
查阅资料2:MgCO3 、Mg(OH)2加热易分解,分别生成两种氧化物。
②为进一步确定白色固体的组成,该同学进行了定量实验:
称取干燥的白色固体22.6 g,充分加热至不再产生气体为止,并使分解产生的气体全部先通过浓硫酸,浓硫酸增重1.8g,则白色固体中含有 ,再通过碱石灰,碱石灰增重8.8g,则固体中MgCO3 与Mg(OH)2的质量比为 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】向氧化铜和铁粉的混合物中加入一定量的稀硫酸.微热.反应后过滤,向滤液中插入铁片,有气泡产生,以下判断正确的是(____)
A.不溶物中一定含有铜 B.滤液中一定含有硫酸铜
C.不溶物中可能含有氧化铜 D.__________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】同学们对制作糕点常用膨松剂Na2CO3或NaHCO3进行了下列探究。
【查阅资料】

【探究一】NaHCO3和Na2CO3性质差异的探究
(1)现有20℃时溶质质量分数为8%的Na2CO3和NaHCO3溶液
酸碱性:取样于试管中,分别滴加紫色石蕊试液,均显__________色;
酸碱度:NaHCO3溶液___________Na2CO3溶液(填“>”或”“<”)。
(2)稳定性:按下图,实验中可观察乙烧杯中的石灰水变浑浊,甲烧杯不变,则乙烧杯对应的试管中发生反应的化学方程式为:_______________。
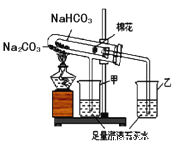
结论:在受热条件下,碳酸钠比碳酸氢钠稳定性___________(填“强”或“弱”)。
(3)利用溶解度鉴别NaHCO3和Na2CO3:分别取Xg两种固体粉末加入20℃,10g水中充分溶解,通过观察溶解现象来区分,X可以是下列的__________。(选填A、B或C)
A.1.5g B.0.96g C.0.5g
【问题讨论】
(4)实验结束时,应先__________(选填A或B)A.熄灭酒精灯 B.把甲、乙烧杯移开
(5)小试管内棉花的作用是_____________
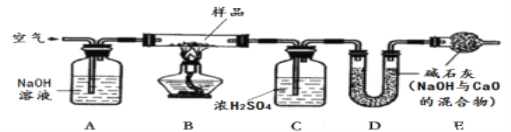
【探究二】测定NaHCO3和Na2CO3混合物10.0g中NaHCO3的质量分数(下图,夹持装置略)
【问题讨论】
(6)实验前先通一段时间的空气的目的是_______________________;
(7)A的作用是_____________________,若没有装置E,NaHCO3的质量分数测定结果会__________________(填“偏大”、“不变”或“偏小”)。
(8)停止加热后,仍继续通入空气一段时间,目的是______________________________。
【含量测定】
(9)测得装置D的质量实验前为120.2g,实验后为122.4g,计算该样品中NaHCO3的质量分数。(要有计算过程)
_______
【知识拓展】
(10)向Na2CO3溶液中通入CO2气体可以生成NaHCO3,该反应的化学反应方程式为:
______________________________________。
相关试题

