【题目】小刚收集到一瓶浑浊的太湖水,他要模拟自来水厂的净水过程,最终制成蒸馏水。其实验过程如下所示。请回答以下问题。
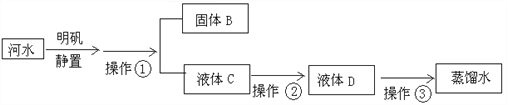
(1)操作①的名称是________,其主要作用是除去水中________杂质(填“可溶性”或“不溶性”)。(2)操作②向滤液C中加入活性炭,利用其________作用除去水样中的颜色和异味。此过程主要发生_______变化(填“物理”、“化学”)。
(3)小刚取少量液体D于试管中,加入少量肥皂水,振荡,发现有较多泡沫出现,此现象说明液体D是_______(填“硬水”、“软水”)。
(4)消毒剂高铁酸钠(化学式为Na2FeO4)集氧化、凝聚、杀菌等功能于一体,目前被广泛应用于自来水净化。高铁酸钠中铁元素的化合价为_______。
参考答案:
【答案】 过滤 不溶性 吸附 物理 软水 +6
【解析】(1)操作①是将固液分离,名称是过滤;主要除去水中的固体杂质;(2)活性炭有吸附性,可以吸附色素和异味;在吸附的过程中没有新物质生成,是物理变化;(3) 加入少量肥皂水,振荡,发现泡沫多浮渣少的水是软水;(4)Na2FeO4中化合价的代数和为0,设铁元素的化合价为x,则1![]() 2+x+(-2)
2+x+(-2)![]() 4=0的x=+6
4=0的x=+6
-
科目: 来源: 题型:
查看答案和解析>>【题目】学习水的组成这一课题后,同学们己经知道水在通电的条件下能生成氢气和氧气。某研究性学习小组同学对电解水的实验很感兴趣,很想通过实验验证这一结论。于是在征得老师同意后进行实验,实验记录如下:
电解时间/min
2
4
6
8
10
12
14
……
负极生成气体体积/mL
7
15
23
31
39
47
55
……
正极生成气体体积/mL
2
5
9
13
17
21
25
……
电解水生成氢气和氧气的理论体积比是多少?如果你是这次实验的参与者、请认真分析实验数据,你会发现什么问题?推测产生这一间题的可能原因。
-
科目: 来源: 题型:
查看答案和解析>>【题目】水是生命之源,人类的日常生活与工农业生产都离不开水。

(1)小刚利用图①所示的装置探究水的组成。通电一段时间后,试管1中所收集的气体为_______,该实验说明水是由_________________组成的。
(2)小刚为了净化收集到的雨水,自制了一个如图②所示的简易净水器,其中小卵石、石英沙和膨松棉的作用是__________________________。
(3)矿泉水、蒸馏水、自来水和净化后的雨水都是生活中常见的“水”,其中属于纯净物的是_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】冰箱所用的材料中含稀土元素钆(Gd),钆元素的一种原子的相对原子质量为157,核电荷数为64,则其原子的中子数为( )
A. 64 B. 57 C. 93 D. 128
-
科目: 来源: 题型:
查看答案和解析>>【题目】图a 是铯元素在元素周期表中的信息,图b 是铝原子结构示意图,图C 为元素周期表的一部分,X、Y、Z 代表三种不同元素。

(1)由图a 可知,铯元素属于____(“金属”或“非金属”)元素;其核外有_____ 个电子;
(2)图b 方框内的数字是______ ;该原子在化学反应中容易_____ (填“失去”或“得到”)电子,形成稳定结构,其离子符号为____________;
(3)有关图C 的说法,正确的是___________(填序号)。
A.原子序数:Z>Y B.核外电子数:X=Y C.Y 和Z 同处于第二周期
-
科目: 来源: 题型:
查看答案和解析>>【题目】结合下列实验装置图回答问题:

(1)写出仪器的名称:①_______________,②_________________.
(2)若用高锰酸钾制取氧气,A装置还缺 _______;该反应的文字表达式为:_____________;该反应类型属于_______ 反应。
(3)若用B装置来制取氧气,实验时,先在锥形瓶中添加二氧化锰,再从长颈漏斗添加过氧化氢溶液;该反应的符号表达式为_____________________;若装置B中反应很剧烈,据此提出实验安全注意事项是____________(选序号).
①控制液体的加入速度 ②用体积较小的锥形瓶 ③加热反应物
(4)氨气极易溶于水,且密度比空气小,实验室常用加热固体硫酸铵和固体熟石灰的混合物来制取氨气,制取氨气的发生装置应选用__________装置,若使用装置E收集氨气,则气体应从___________(填“c”或“d”)通入.
-
科目: 来源: 题型:
查看答案和解析>>【题目】写出下列反应的符号表达式(用化学式表示)
(1)红磷燃烧_____;
(2)电解水_____;
(3)氯酸钾分解_____;
(4)过氧化氢分解_____.
相关试题

