【题目】实验室有一瓶硫酸废液,老师请小红同学设计方案测定该废液中硫酸的质量分数.小红同学先取一纯净小烧杯,称其质量为18.2g,然后往其中倒入少量硫酸废液后称量,总质量为33.2g,之后,将一枚质量为10.8g的铁钉(已用砂纸砂去铁锈)放入该小烧杯中反应,待铁钉表面不再有气泡产生后,再次称量,总质量为43.9g.请回答下列问题:
(1)反应中产生的气体的质量是 。
(2)计算该废液中硫酸的质量分数(写出计算过程,计算结果保留一位小数).
(3)如果铁钉的铁锈未除净,对(2)计算结果的影响是 (选填“偏大”、“偏小”、“无影响”),原因是 。
参考答案:
【答案】0.1g;设与铁反应的硫酸的质量为x
Fe+H2SO4═FeSO4+H2↑
98 2
X0.1g
![]() x=4.9g,
x=4.9g,
该废液中硫酸的质量分数为:![]() ×100%=32.7%;答:废液中硫酸的质量分数是32.7%;
×100%=32.7%;答:废液中硫酸的质量分数是32.7%;
偏小;铁锈也能消耗一部分硫酸。
【解析】
试题分析:铁和稀硫酸反应生成硫酸亚铁和氢气,铁锈和稀硫酸反应生成硫酸铁和水;根据质量差可以求生成氢气的质量:容器中的物质的质量差,就是生成氢气的质量,氢气的质量为:33.2g+10.8g﹣43.9g=0.1g;设与铁反应的硫酸的质量为x,结合化学方程式求得硫酸的质量;小烧杯中稀硫酸废液的质量为:33.2g﹣18.2g=15.0g,再用溶质质量分数计算公式即可求得;如果铁钉的铁锈未除净,则铁锈消耗一部分硫酸,根据氢气求出的硫酸质量就偏小,从而使计算出的硫酸的质量分数偏小。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学用相同的铁钉探究铁生锈与哪些因素有关,设计的实验如图。经过一周观察:试管A和C中的铁钉无明显变化,试管B中的铁钉明显锈蚀。
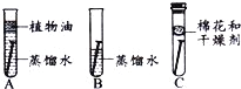
(1)通过探究发现:铁生锈是铁与 共同存在时发生化学反应的过程。
(2)A中加入的蒸馏水要事先煮沸,其目的是 ;
(3)通过探究,请你写出防止铁制品生锈的一种措施 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室欲配制1000g溶质质量分数为4%的氢氧化钠溶液。请回答下列问题;
(1)配制步骤
①计算:需氢氧化钠固体 g,水960mL(水的密度是1 g/cm3)。
②称量:用质量为23.1 g的烧杯作称量容器,托盘天平上称取氢氧化钠固体时,盛有氢氧化钠固体的烧杯应放在左盘。
③溶解:将氢氧化钠固体溶于水,用玻璃棒搅拌,使氢氧化钠全部溶解,冷却至室温。
④装瓶:把配好的溶液装入试剂瓶,盖好瓶盖并贴上标签,放入试剂柜中。
请在装有所配制溶液的试剂瓶(见下图)标签上标明相应的信息。

(2)配制过程,导致溶液中氢氧化钠质量分数小于4%的可能原因是
①用量筒量取水时俯视读数;②配制溶液的烧杯用少量蒸馏水润洗;③用托盘天平称取氢氧化钠,将氢氧化钠放置在右盘;④盛装溶液的试剂瓶用蒸馏水润洗;⑤氢氧化钠固体不纯。
(3)若老师提供的药品有500 g 8%的氢氧化钠溶液,500 g 1%的氢氧化钠溶液,足量的氢氧化钠固体和水,除了上述配制方案外,你还可以设计出哪些配制方案,请你写出其中的一种: .(只要说明配制时所需的各种药品及用量即可)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】2007年10月20日,我国成功发射第一颗绕月探测卫星“嫦娥一号”。人类探月的重要目的之一是勘探、获取地球上蕴藏量很小而月球上却很丰富的核聚变燃料—“He-3”,解决地球能源危机.发射火箭常用高氯酸铵(NH4ClO4作燃料,其反应的化学方程式为:
2NH4C1O4 △ N2↑+Cl2↑+4x↑+2O2↑。试回答下列问题:
(1)x的化学式为 ;
(2)高氯酸铵(NH4ClO4)中氯元素的化合价为 ;
(3)氦—3原子核是由一个中子和两个质子构成的,其原子结构示意图为( )
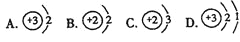
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列属于化学研究范畴的是( )
A. “神七”飞船轨道的研究 B. 动植物细胞的组成和结构
C. “禽流感”传播途径的调查 D. 新型材料的研制
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于自然界中的水的说法正确的是
A. 地球上的淡水资源取之不尽,用之不竭
B. 水体污染的来源主要有工业污染、农业污染和生活污染
C. 水分解可以得到氢气,因此水是廉价且清洁的能源物质
D. 水的软化是将海水变成可饮用的淡水
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关燃烧的主要现象描述错误的是
A. 木炭在氧气中燃烧,发出白光
B. 红磷中空气中燃烧,产生大量白烟
C. 硫粉在空气中燃烧,产生蓝紫色火焰
D. 铁丝在氧气中燃烧,火星四射,生成黑色固体
相关试题

