【题目】日常生活中所说的盐,通常指食盐(主要成分是氯化钠)。
(1)氯化钠是由___________(写粒子符号)构成的;
(2)通过晾晒海水,可以蒸发除去水分,得到粗盐。通常不采用降低海水温度的方法得到粗盐,是因为_________________________________,相同情况下降温析出的晶体比较少;
(3)根据“粗盐中难溶性杂质的去除”实验,回答有关问题:
①溶解 称取5.0g粗盐,逐渐加入10mL水中,直到不再溶解,剩余粗盐1.1g。
②过滤
③蒸发 在加热过程中,用玻璃棒不断搅拌,防止______________________________________。当蒸发皿中______________________,停止加热。
④计算产率 得到精盐3.3g,则精盐的产率为___________(计算结果保留一位小数)。
(4)若经过上述实验得到的精盐中还含有氯化镁、氯化钙,为了除去这两种可溶性杂质,可将得到的精盐全部溶于水,加入过量的氢氧化钠溶液和___________________溶液,充分反应后,接下来的操作顺序是__________________(填序号)。
①蒸发 ②加入过量的稀盐酸 ③过滤
参考答案:
【答案】 Na+、Cl— NaCl溶解度受温度变化的影响很小 局部温度过高,导致液滴飞溅 出现较多固体 84.6% Na2CO3 ③②①
【解析】(1)根据物质的构成分析;
(2)根据氯化钠的溶解度受温度影响变化较小分析;
(3)③根据蒸发过程中玻璃棒的作用及蒸发时停止加热的时间分析;
④根据精盐与所溶解的粗盐的质量比解答;
(4)根据粗盐中可溶性杂质的去处方法分析。
解:(1)氯化钠是离子化合物,故氯化钠是由Na+、Cl—构成的;
(2)实验中不采用降低海水温度的方法得到粗盐,是因为氯化钠的溶解度受温度影响变化较小,相同情况下降温析出的晶体比较少;
(3)③在加热过程中,用玻璃棒不断搅拌,防止局部温度过高,导致液滴飞溅。当蒸发皿中出现较多固体,停止加热;
④![]() =84.6%;
=84.6%;
(4)加入过量的氢氧化钠溶液除去氯化镁的杂质,要除去氯化钙必须加入过量的Na2CO3溶液,然后过滤除去生成的氢氧化镁、碳酸钙,再加入过量的稀盐酸除去
过量的氢氧化钠溶液和过量的稀盐酸,最后蒸发结晶。故填Na2CO3 ③②①。
-
科目: 来源: 题型:
查看答案和解析>>【题目】各校开运动会的田径项目比赛都要用到发令枪,枪响后,看到有白烟产生。该白烟的主要成分是
A、二氧化硫 B、二氧化碳 C、一氧化碳 D、五氧化二磷
-
科目: 来源: 题型:
查看答案和解析>>【题目】溴元素的原子结构示意图和其在周期表中的某些信息如图所示。下列说法不正确的是( )

A. 溴元素为非金属元素
B. 溴元素的原子结构示意图中,n=5
C. 溴元素的相对原子质量为79.90
D. 溴元素在周期表中位于第四周期
-
科目: 来源: 题型:
查看答案和解析>>【题目】图中A~I是初中化学常见的物质,且分别是由H、O、Na、Al、S、Cl、Cu、Ba中的一种或几种元素组成的。C为紫红色固体;E能与油脂反应,在生活中可用来去除油污;B、D、G、I为相同类别的化合物。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。
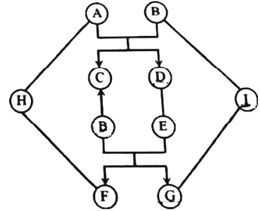
(1)写出化学式E:_____________。
(2)写出化学方程式:
A与B的反应_______________________________________;
H与F的反应_______________________________________;
G与I的反应_______________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列食品包装措施中,不能有效防止食品腐败的是
A.填充空气 B.填充氮气 C.填充二氧化碳 D.抽成真空
-
科目: 来源: 题型:
查看答案和解析>>【题目】向一定质量的FeSO4和CuSO4的混合溶液中加入一定质量的锌粉,充分反应后过滤,得滤液和滤渣,向滤渣中加入稀盐酸,有气泡产生,根据实验现象分析判断下列说法中不正确的是
A. 滤液的颜色呈蓝色 B. 滤液中可能存在Fe2+
C. 滤渣中一定含有Fe、Cu、Zn D. 滤渣中一定含有Fe和Cu可能含有Zn
-
科目: 来源: 题型:
查看答案和解析>>【题目】某品牌高钙牛奶中富含蛋白质、油脂、糖类、无机盐等营养物质,下列叙述错误的是
A. 蛋白质、糖类都属于有机物 B. 人体缺钙易引起甲状腺肿大
C. 油脂由C、H、O三种元素组成 D. 误食重金属盐可喝鲜牛奶解毒
相关试题

