【题目】分解水制氢气的一种原理如图。下列关于该原理的说法正确的是
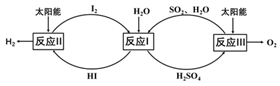
A. 涉及的反应类型有分解反应和化合反应
B. 反应过程中S元素的化合价未发生改变
C. 理论上,每生成8g O2,就能得到1g H2
D. 理论上,每分解36 g H2O,就需要向体系内再补充64 g SO2
参考答案:
【答案】C
【解析】A、反应2和反应3 都是分解反应,反应1表示基本反应类型,错误;
B、反应1中,二氧化硫中的硫元素的化合价是+4价,生成物中硫酸中的硫元素的化合价为+6价,故硫元素的化合价发生了改变,错误;
C、整个过程中碘和二氧化硫做催化剂,在太阳能的作用下,水分解生成氢气和氧气,故生成氧气和氢气的质量不为8:1,正确;
D、二氧化硫是催化剂,故不需要填补二氧化硫,错误。故选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】归纳总结是学习化学的重要方法,某化学兴趣小组学习碱的性质后,通过实验对氢氧化钙的化学性质进行了验证和总结,如图所示“____”表示物质之间能发生化学反应。请回答问题:

(1)甲同学将酚酞试液滴入氢氧化钙溶液中,观察到溶液变红,得出结论:氢氧化钙溶液呈_____性。乙同学将过量的稀盐酸加入到甲同学所得溶液中,此时所得溶液中含有的溶质有_________
(2)丙同学将碳酸钠溶液加入氢氧化钙溶液中,充分反应后,与乙同学所得溶液混合,静置后发现:上层为无色透明的溶液,底部有白色沉淀,则上层溶液中一定含有的溶质是__________(酸碱指示剂除外),可能含有的溶质是________,为验证可能含有的溶质,可加入试剂_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是前20号常见元素和粒子的相关信息,请完成下列内容。
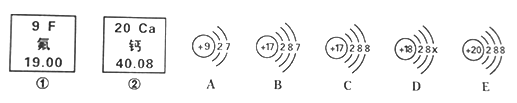
(1)图中涉及到的元素种类有__________________种;X=_____________________;
(2)请写出C粒子的符号_____________________;钙元素处于第__________周期;
(3)A粒子的化学性质与B、C、D中哪一种粒子的化学性质相似_______ (填序号)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】分析甲乙两种固体的溶解度曲线,回答下列问题:
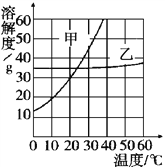
(1)观察图像,溶解度受温度影响不大的物质是_____________
(2)欲使30℃甲的饱和溶液转化为不饱和溶液,除可采用升高温度的方法外,还可采用的方法 ________________________
(3)在20℃时,将25克甲放入100克水中,充分搅拌后,从溶液是否饱和的角度看,所得溶液在20℃是_____溶液,此时溶质的质量分数为__________________
(4)甲中混有少量乙,提纯甲的方法____________
-
科目: 来源: 题型:
查看答案和解析>>【题目】(题文)(1)请你用最合适的化学式或微粒符号填空:空气中含量最多的气体________;硫酸钠中的阴离子________;改良酸性土壤时常用的一种碱:_________;。
(2)豆浆机由于快捷方便而进入千家万户。请根据图示回答:
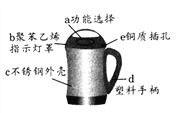
①制作材料中属于金属或合金的是_______(选填一种物质编号),属于有机合成材料的是_________(选填一种物质编号);制作手柄的塑料属于____________塑料(填“热塑性”或“热固性”);
②豆浆已成为众多家庭的早餐饮品,以下是豆浆中一些营养成分的平均质量分数。请根据下表回答:
成分
水
蛋白质
脂肪
糖类
钙
磷
铁
维生素A
质量分数/%
96.0
1.8
0.7
1.1
0.01
0.03
0.0005
0.015
豆浆中含有的微量元素是__________;青少年缺乏______元素易患有佝偻病。在豆浆所含的营养素中能供给人体能量的营养素有______________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)下图是某种品牌的补钙药品的部分说明书。请回答下列问题:
XX钙片
[药品规格] 每片含CaCO3 0.625g
[用法用量] 每次一片,每天2次
①CaCO3的相对分子质量是_________。 ②如果按用量服用,每天摄入钙元素的质量为___________g。
(2)为解决化石燃料日益枯竭的危机,人类正在研究利用光解的方法制取未来理想燃料——氢气,请计算2升水理论上可以制得_________克的氢气。目前氢能源还不能广泛使用的原因是(至少答一条):____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某工厂生产的烧渣(主要含有FeO、Fe2O3和SiO2),可用于制备七水合硫酸亚铁晶体(FeSO4·7H2O),其工艺流程如下:
(资料:SiO2不溶于水,也不与稀硫酸反应。)
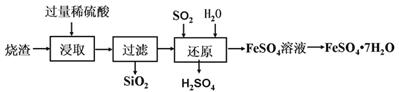
(1)“浸取”步骤中,发生反应的化学方程式有_________、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O。
(2)为提高“浸取”步骤的反应速率,可采取的具体措施有_________________(写1条,不考虑“搅拌”、“使用催化剂”)
(3)“还原”的目的是将Fe3+转化为Fe2+。写出“还原”过程中反应的化学反应方程式________________。
(4)该工艺中可循环利用的物质是__________________。
相关试题

