【题目】在氯化钙和氯化钠的混合物中加入一定量的水,全部溶解得到50克混合溶液,向该溶液中逐滴加入一定溶质质量分数的碳酸钠溶液,生成沉淀与加入碳酸钠溶液的质量关系如图所示.计算:
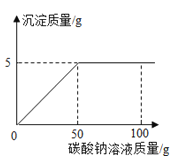
(1)所加碳酸钠溶液的溶质质量分数.
(2)若恰好完全反应时所得溶液的溶质质量分数为10%,则原固体混合物的质量是多少?
参考答案:
【答案】(1)10.6% (2)8.95g
【解析】
试题分析:根据图像,利用化学方程式,根据各物质的质量比即可计算出各物质的质量。
(1)由图象可知,CaCO3的质量为5g,
设原混合物中碳酸钠的质量为x,生成氯化钠的质量为y.
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100 117
x 5g y
106/x =100/5g 117/y =100/5g
x=5.3g y=5.85g
所加碳酸钠溶液的溶质质量分数为:5.3g/50g ×100%=10.6%
(3)原固体混合物的质量是w
所以![]() ×100%=10%
×100%=10%
w=8.95g
答:略
-
科目: 来源: 题型:
查看答案和解析>>【题目】固体混合物A是由Mg、CuO、Na2SO4、Na2CO3、BaCl2、BaSO4中的几种混合而成为,为确定其成分,进行如图实验.(假设每步反应均恰好完全反应)
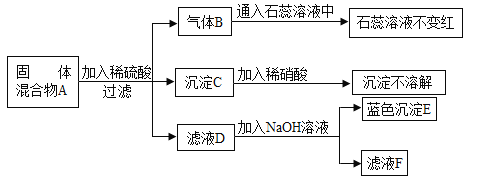
试推断:
(1)气体B是 。
(2)固体A中一定没有的物质是 。
(3)滤液D中一定有含有的溶质是 。
(4)固体A的组成可能有 种。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质的用途跟其化学性质相关的是
A.干冰用于人工降雨 B.铁粉用于食品保存
C.稀有气体用来制作电光源 D.铜用作电线
-
科目: 来源: 题型:
查看答案和解析>>【题目】
(1)用化学符号填空:
①两个铁离子
②硫酸中硫元素的化合价
③
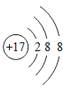 表示的是
表示的是 (2)汽油中加入适量的乙醇作为汽车燃料,可适当节省石油资源,并减少污染,写出乙醇在空气中燃烧的化学方程式 .
(3)在一个密闭容器中有A、B、C、D四种物质,在一定条件下充分反应,测得数据如下:
物质
A
B
C
D
反应前的质量/g
6.4
3.2
4.0
2.8
反应后的质量/g
5.2
待测
7.2
2.0
反应后待测的B的质量是 克,该反应所属的基本反应类型是 .
(4)现有铁、氧化铜、稀盐酸、氢氧化镁、氢氧化钠溶液、硫酸铜溶液六种物质,两两混合能发生的反应有 个。
-
科目: 来源: 题型:
查看答案和解析>>【题目】氮肥能促进植物茎、叶生长旺盛,提高植物蛋白质的含量,下列化肥中属于氮肥的是
A.K2SO4 B.Ca3(PO4)2 C.NH4H2PO4 D.CO(NH2)2
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列应用和相应的原理(用化学方程式表示)及基本反应类型都正确的是
A.用熟石灰制生石灰 CaO+H2O═Ca(OH)2 化合反应
B.实验室用氯酸钾和二氧化锰混合物制取氧气 2KClO3
 2KCl+3O2↑ 分解反应
2KCl+3O2↑ 分解反应C.用酒精作燃料 C2H5OH+3O2
 2CO2+3H2O 置换反应
2CO2+3H2O 置换反应D.用Al(OH)3中和胃酸 2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O 复分解反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】对于反应:X + 2 NaOH == 2 Y + Cu(OH)2↓ ,下列分析中正确的是
A.X 只可能是CuCl2 B.X 和Y 的相对分子质量之差为18
C.Y 中一定含有钠元素 D.Y 可能是Na2SO4
相关试题

