【题目】水在生产、生活中有着十分重要的作用。
①科学家在不断研究水的开发和利用技术。下图是水在一定条件下的转化过程。
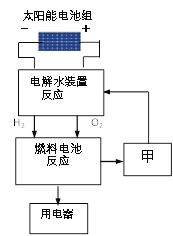
Ⅰ.写出电解水装置反应的化学方程式_______________。
Ⅱ.燃料电池反应的微观模拟图如下图所示
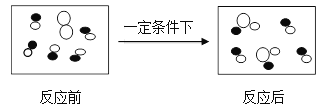
“ ![]() ”表示的微粒名称是____________;反应后的容器中成分判断正确的是________。(选填编号)
”表示的微粒名称是____________;反应后的容器中成分判断正确的是________。(选填编号)
A.是混合物 B. 氧元素只存在化合态
C. 原子总数减少 D. 分子总数减少
Ⅲ.该转化过程中,可循环利用的甲物质是________。该技术的优点是_______。(选填编号)
A. 开发使用新能源 B. 减少生产过程对环境的污染
C. 可以彻底替代化石燃料 D. 主要用于证明水的组成
②净化水有多种方法。
Ⅰ.活性炭去除异味,活性炭主要起_____________作用。消毒水时常用二氧化氯,ClO2中氯元素的化合价是_________。
Ⅱ.应急净水器可以将海水淡化。如用此装置将2000 g含氯化钠3%的海水暴晒4小时,可收集到500 g可饮用水,此时剩余海水中氯化钠的质量分数为________。
参考答案:
【答案】 ![]() 一个氢分子/氢分子 ABD H2O或水 AB 吸附 +4 4%或1/25或0.04
一个氢分子/氢分子 ABD H2O或水 AB 吸附 +4 4%或1/25或0.04
【解析】①Ⅰ.水在通电的条件下生成氢气和氧气,化学方程式为:2H2O![]() 2H2↑+O2↑;Ⅱ. “
2H2↑+O2↑;Ⅱ. “ ![]() ”表示的微粒名称是氢分子,反应后的容器中成分判断:A.是混合物,正确; B、氧元素只存在化合态,正确;C、原子总数减少 ,原子总数不变,错误; D、分子总数减少,正确;Ⅲ.该转化过程中,可循环利用的甲物质是水,该技术的优点是:开发使用新能源 ;减少生产过程对环境的污染;②Ⅰ.活性炭去除异味,活性炭主要起吸附作用;设ClO2中氯元素的化合价是x,根据化合价代数和为0得,x+(-2)×3=0,x=+4;Ⅱ、2000 g含氯化钠3%的海水中氯化钠的质量为2000g×3%=60g,所以剩余海水中氯化钠的质量分数为
”表示的微粒名称是氢分子,反应后的容器中成分判断:A.是混合物,正确; B、氧元素只存在化合态,正确;C、原子总数减少 ,原子总数不变,错误; D、分子总数减少,正确;Ⅲ.该转化过程中,可循环利用的甲物质是水,该技术的优点是:开发使用新能源 ;减少生产过程对环境的污染;②Ⅰ.活性炭去除异味,活性炭主要起吸附作用;设ClO2中氯元素的化合价是x,根据化合价代数和为0得,x+(-2)×3=0,x=+4;Ⅱ、2000 g含氯化钠3%的海水中氯化钠的质量为2000g×3%=60g,所以剩余海水中氯化钠的质量分数为![]() 。
。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室开放日,某化学新区小组的同学在老师的知道下,设计了如下实验装置进行气体制取和性质的探究,请回答有关问题:

(1)请写出途中标有字母的仪器名称:a______ b_______________
(2)实验室要得到较为纯净的氧气,最好选用的收集装置是______(填字母序号)
(3)实验室制取二氧化碳气体是,选用的试剂是____________,应选择的发生装置是______(填字母序号)写出实验室制取二氧化碳气体是,发生的化学方程式_______________;
(4)如图F所示,向烧杯中倾倒二氧化碳,下层蜡烛先熄灭,上层蜡烛后熄灭,说明二氧化碳具有的性质是__________________,密度比空气大,因此,二氧化碳可用于______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某学习小组的同学对物质燃烧知识进行了整理和探究,请你一起参与:
(1)木炭燃烧试验:
①木炭在氧气中燃烧的现象是____________,完全燃烧的化学方程式是______________________
②检验右图集气瓶中木炭完全燃烧产物的方法是__________________
(2)对燃烧是否产生火焰的探究【发现问题】木炭在空气和氧气中燃烧均不产生火焰,而氧气,蜡烛,酒精等在空气或氧气中燃烧都产生火焰,那么无知燃烧是否产生火焰与什么因素有关呢?
【提出假设】a.与氧气的浓度有关;b.与可燃物的状态有关;c.与燃烧达到的温度和可燃物的沸点的相对大小有关
【资料整理】小组同学查阅资料归纳【得出结论】
物质名称
物质状态
沸点(℃)
燃烧达到温度(℃)
是否产生火焰
氢气
气
-259
约2750
是
一氧化碳
气
约-190
约2500
是
木炭
固
约4827
约1200
否
石蜡
固
约300
约600
是
钠
固
约883
约1400
是
铁
固
约2750
约1800
否
①通过木炭在空气和氧气中燃烧均不产生火焰,可以得出假设a___________(填“合理”或“不合理”);
②分析表中数据,可以得出有关假设b的结论是________________________________;
③分析表中数据,可以是出有关假设c的结论是________________________________;
【验证结论】现有下列用品蜡烛、火柴、注射器、玻璃管,请你根据这些用品设计实验验证石蜡蒸气燃烧能产生火焰。______________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学与生活密切相关。
①下图是营养药品的部分说明。说明中的“铁”指的是________(填“单质”、“元素”或“分子”);丙酸钠是由________种元素组成。1molC3H5OxNa中含有______个碳原子;该化合物中碳元素与氧元素的质量比为9∶8则x=_________。
营养成分
每片含量
每100g含量
铁Fe
6.70mg
1.12g
丙酸钠C3H5OxNa
0.23mg
45.50mg
②变色眼镜的玻璃里加入了溴化银(AgBr)和氧化铜。在强光照射下,溴化银分解成溴和银,玻璃颜色变深,此属于_________反应(填“化合反应”或“分解反应”);当光线变暗时,溴和银在氧化铜作用下,重新生成溴化银,玻璃颜色变浅,而氧化铜在变化前后质量和化学性质没有变化,则氧化铜在反应中起_________作用。眼镜的铜螺丝部位常出现一层绿色物质,这是由于铜生锈的原因:请完成该反应的化学方程式:2Cu+O2+__________+H2O=Cu2(OH)2CO3
-
科目: 来源: 题型:
查看答案和解析>>【题目】下表是氯化钠和硝酸钾在不同温度下的溶解度。(假设硝酸钾与氯化钠同时溶解在水中各自的溶解度不变,实验过程中水分损失忽略不计)。
温度(℃)
0
20
40
60
80
100
溶解度(g/100g水)
KNO3
13.3
31.6
64.0
110.0
169.0
246.0
NaCl
35.7
36.0
36.6
37.3
38.4
39.8
①由表可知,20℃时,氯化钠的溶解度是________。影响硝酸钾溶解度的因素是_________。
②在80℃的100g水中溶解NaCl和KNO3,进行以下实验:
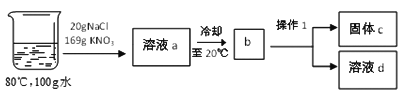
Ⅰ.操作1的名称是_________。
Ⅱ.溶液a冷却至b的过程中出现的现象是__________。溶液d中所含的溶质是_________。
Ⅲ.对整个实验过程分析正确的是_________。
A.无法判断a、d溶液中氯化钠溶液的状态 B.固体c是纯净物
C.溶液a中硝酸钾的质量分数为
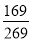 D.硝酸钾溶液始终处于饱和状态
D.硝酸钾溶液始终处于饱和状态 -
科目: 来源: 题型:
查看答案和解析>>【题目】实验室制备二氧化碳的实验装置如下图所示。
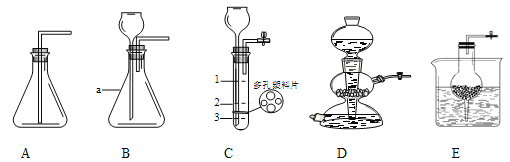
①写出仪器名称:a_______,D的装置的名称是________。此时D装置的开关处于_________状态(选填“开”或“关”)。E与D装置制取气体具有相同的优点是_________。
②观察A~E装置,____________装置(选填编号)进行实验时,集气瓶中不能收集得到二氧化碳,原因是_______________。
③用C装置制取CO2,反应时装置内盐酸液面应位于_____________处(选填“1、2或3”)为宜,理由是_______________。
④测定其大理石中碳酸钙的质量分数。在15g大理石中分5次共加入50.0g稀盐酸(假设杂质不与盐酸反应,忽略盐酸的挥发),部分数据如下表。
容器中盐酸的质量
10
20
40
50
气体质量m/g
1.1
2.2
m
4.4
根据实验数据回答下列问题:
Ⅰ. 当盐酸滴入40g时,对应的气体质量m是________g。
Ⅱ. 大理石中碳酸钙的质量分数是_______。(根据化学方程式列式计算,结果精确到0.1%)
-
科目: 来源: 题型:
查看答案和解析>>【题目】某气体可能含有CO2 、 CO一种或二种。为探究其成分进行以下实验。
[实验步骤]
步骤一:打开K,缓缓通入干燥的氮气一段时间,关闭K。
步骤二:通入待测气体,同时打开K,点燃酒精灯,进行实验。
[实验结论] 该气体是CO、CO2混合物。
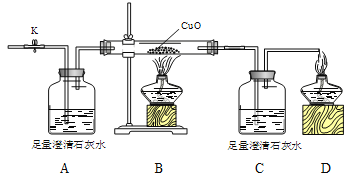
回答问题:
①写出B中玻璃管内发生反应的化学方程式______________。
②实验过程中,根据_______________实验现象可以判断该气体的成分。
③对该实验的分析正确的是___________(选填编号)
Ⅰ.步骤一的目的是为了把容器中空气反应完
Ⅱ.C中增加的质量与B中固体减少的质量相等
Ⅲ.省略C装置对检验的结果没有影响
Ⅳ.反应结束后继续通气体的目的是防止生成的铜与空气中氧气反应
V.实验结束应先灭B处的酒精灯
相关试题

